Διαφορά μεταξύ τροχιακών 4f και 5f
Κύρια διαφορά – 4f έναντι 5f τροχιακά
Τα άτομα αποτελούνται από έναν πυρήνα που αποτελείται από πρωτόνια και νετρόνια, τα οποία περιβάλλονται από ηλεκτρόνια. Αυτά τα ηλεκτρόνια βρίσκονται σε συνεχή κίνηση γύρω από τον πυρήνα. Επομένως, δεν μπορούμε να δώσουμε μια συγκεκριμένη θέση για ένα ηλεκτρόνιο σε ένα άτομο. Αντί να εντοπίσουν την ακριβή θέση ενός ηλεκτρονίου, οι επιστήμονες εισήγαγαν την έννοια της «πιθανότητας». Με άλλα λόγια, καθορίζεται η πιο πιθανή οδός που είναι πιο πιθανό να κινείται ένα ηλεκτρόνιο. Αυτό το μονοπάτι ονομάζεται τροχιακό. Υπάρχουν διαφορετικά υποσύνολα τροχιακών όπως s τροχιακά, p τροχιακά, d τροχιακά και f τροχιακά. Ο αριθμός των τροχιακών σε κάθε υποσύνολο καθορίζεται από τον μαγνητικό κβαντικό αριθμό. Για f τροχιακά, υπάρχουν 7 πιθανοί μαγνητικοί κβαντικοί αριθμοί, άρα υπάρχουν επτά f τροχιακά. Τα τροχιακά 4 f και 5 f είναι το πρώτο σύνολο και το δεύτερο σύνολο στα τροχιακά f. Η κύρια διαφορά μεταξύ των τροχιακών 4f και 5f είναι ότι τα τροχιακά 4f έχουν έναν αριθμό επιπέδων και κωνικών κόμβων, αλλά όχι ακτινωτούς κόμβους, ενώ τα 5f έχουν έναν αριθμό επιπέδων και κωνικών κόμβων και κάθε τροχιακό έχει έναν ακτινωτό κόμβο.>
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα 4f τροχιακά
– Ορισμός, επτά τροχιακά και οι σχετικές ομοιότητές τους
2. Τι είναι τα 5f Orbitals
– Ορισμός, επτά τροχιακά και οι σχετικές ομοιότητές τους
3. Ποιες είναι οι ομοιότητες μεταξύ 4f και 5f τροχιακών
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ 4f και 5f τροχιακών
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Άτομο, ηλεκτρόνιο, λοβοί, μαγνητικός κβαντικός αριθμός, κόμβοι, πυρήνας, τροχιακό, πιθανότητα, υποκέλυφος

Τι είναι τα 4f Orbitals
Τα τροχιακά 4f είναι τα επτά τροχιακά f του κελύφους των 4 ηλεκτρονίων (ενεργειακό επίπεδο). Τα τροχιακά 4f είναι το πρώτο υποσύνολο των τροχιακών f. Αυτό σημαίνει ότι τα κελύφη ηλεκτρονίων 1, 2 και 3 δεν έχουν f τροχιακά. Αυτό φαίνεται παρακάτω στον πίνακα των τροχιακών s, p, d και f.
| Electron Shell | Τροχιακά |
| 1 | s |
| 2 | s, p |
| 3 | s, p, d |
| 4 | s, p, d, f |
| 5 | s, p, d, f |
Ένα σύνολο τροχιακών 4f έχει τέσσερα διαφορετικά σχήματα, καθένα από τα οποία έχει έναν αριθμό επίπεδων και κωνικών κόμβων. Αλλά τα τροχιακά 4f δεν διαθέτουν ακτινωτούς κόμβους. Τα επτά τροχιακά 4f ονομάζονται σύμφωνα με το επίπεδο του τροχιακού. Παρακάτω δίνονται τα επτά τροχιακά 4f.
- 4fxyz
- 4fz3
- 4fz(x2-y2)
- 4fy(3×2-y2)
- 4fx(x2-3y2)
- 4fxz2
- 4fyz2
Μεταξύ αυτών των τροχιακών, και τα δύο 4fxyz και 4fz(x2-y2) τα τροχιακά έχουν οκτώ λοβούς. Σχετίζονται μεταξύ τους με περιστροφή 45 γύρω από τον άξονα z. Αυτό σημαίνει ότι είναι παρόμοια σε άλλους παράγοντες, αλλά είναι διαφορετικά στο επίπεδο.
Ανάμεσα στα υπόλοιπα επτά τροχιακά, 4fy(3×2-y2) και 4fx(x2-3y2) τα τροχιακά σχετίζονται μεταξύ τους περιστρέφοντας 90 γύρω από τον άξονα z. Κάθε τροχιακό έχει έξι λοβούς που χωρίζονται από τρία κομβικά επίπεδα που έχουν γωνία 60 μεταξύ τους. Το 4fxz2 και 4fyz2 τα τροχιακά φαίνονται παρόμοια με 4fy(3×2-y2) και 4fx(x2-3y2) τροχιακά αλλά είναι διαφορετικά επειδή τα τρία κομβικά επίπεδα των έξι επιπέδων δεν χωρίζονται από 60 γωνίες. Αυτά τα 4fxz2 και 4fyz2 τα τροχιακά έχουν δύο από τους έξι λοβούς «φασολιού» στον άξονα z. Από την άλλη πλευρά, 4fxz2 Το τροχιακό είναι παρόμοιο τροχιακό με αυτό του 4fxz2 και 4fyz2 τροχιακά, αλλά οι λοβοί σε σχήμα φασολιού βρίσκονται στον άξονα x. Στο 4fyz2 τροχιακό, το τροχιακό "σε σχήμα φασολιού" βρίσκεται στον άξονα y.
Τι είναι τα 5f Orbitals
Τα τροχιακά 5f είναι τα επτά τροχιακά f του κελύφους των 5 ηλεκτρονίων (ενεργειακό επίπεδο). Τα τροχιακά 5f είναι το δεύτερο υποσύνολο των τροχιακών f. Αυτά τα τροχιακά ονομάζονται με βάση τα επίπεδα των τροχιακών. Τα επτά τροχιακά είναι τα εξής.
- 5fxyz
- 5fz3
- 5fz(x2-y2)
- 5fy(3×2-y2)
- 5fx(x2-3y2)
- 5fxz2
- 5fyz2
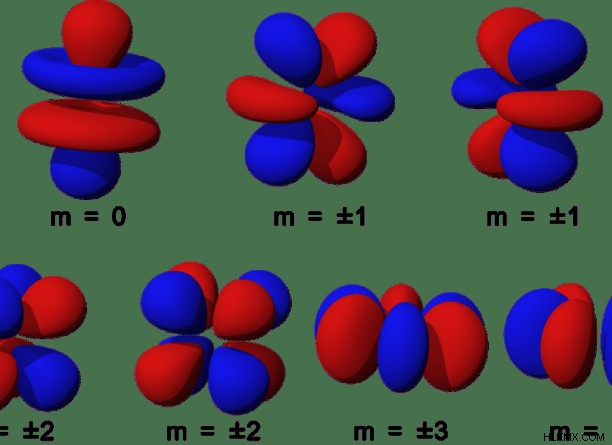
Εικόνα 1:Επτά διαφορετικά τροχιακά
Ένα σύνολο τροχιακών 5f έχει τέσσερα διαφορετικά σχήματα, καθένα από τα οποία έχει έναν αριθμό επίπεδων και κωνικών κόμβων. Κάθε τροχιακό 5f διαθέτει επίσης έναν ακτινωτό κόμβο.
Μεταξύ αυτών των τροχιακών, και τα δύο 5fxyz και 5fz(x2-y2) τα τροχιακά έχουν οκτώ λοβούς. Σχετίζονται μεταξύ τους με περιστροφή 45 γύρω από τον άξονα z. Αυτό σημαίνει ότι είναι παρόμοια σε άλλους παράγοντες, αλλά διαφέρουν στο επίπεδο στο οποίο κατευθύνονται.
Ανάμεσα στα υπόλοιπα επτά τροχιακά, 5fy(3×2-y2) και 5fx(x2-3y2) τα τροχιακά σχετίζονται μεταξύ τους περιστρέφοντας 90 γύρω από τον άξονα z. Κάθε τροχιακό έχει έξι λοβούς που χωρίζονται από τρία κομβικά επίπεδα που έχουν γωνία 60 μεταξύ τους. Το 5fxz2 και 5fyz2 τα τροχιακά φαίνονται παρόμοια με αυτά του 5fy(3×2-y2) και 5fx(x2-3y2) τροχιακά, αλλά είναι διαφορετικά επειδή τα τρία κομβικά επίπεδα των έξι επιπέδων δεν χωρίζονται από 60 γωνίες. Αυτά τα 5fxz2 και 5fyz2 Τα τροχιακά έχουν επίσης δύο από τους έξι λοβούς «φασολιού». Από την άλλη, το 5fxz2 Το τροχιακό είναι παρόμοιο τροχιακό με αυτό του 5fxz2 και 5fyz2 τροχιακά, αλλά οι λοβοί σε σχήμα φασολιού βρίσκονται στον άξονα x. Στο 5fyz2 τροχιακό, το τροχιακό "σε σχήμα φασολιού" βρίσκεται στον άξονα y.
Ομοιότητες μεταξύ 4f και 5f Orbitals
- Και οι δύο είναι f τροχιακές μορφές.
- Και τα δύο έχουν παρόμοια σχήματα στα ίδια επίπεδα.
- Και τα δύο έχουν περίπλοκες δομές τροχιακών.
Διαφορά μεταξύ τροχιακών 4f και 5f
Ορισμός
4f Τροχιακά: Τα τροχιακά 4f είναι τα επτά τροχιακά f του 4ου κελύφους ηλεκτρονίων (ενεργειακό επίπεδο).
5f Τροχιακά: Τα τροχιακά 5f είναι τα επτά τροχιακά f του 5ου κελύφους ηλεκτρονίων (ενεργειακό επίπεδο).
Υποσύνολο
4f Τροχιακά: Τα τροχιακά 4f είναι το πρώτο υποσύνολο των τροχιακών f.
5f Τροχιακά: Τα τροχιακά 5f είναι το δεύτερο υποσύνολο των τροχιακών f.
Ακτινικοί κόμβοι
4f Τροχιακά: Τα τροχιακά 4f έχουν έναν αριθμό επιπέδων και κωνικών κόμβων, αλλά όχι ακτινωτούς κόμβους.
5f Τροχιακά: Τα τροχιακά 5f έχουν έναν αριθμό επιπέδων και κωνικών κόμβων και κάθε τροχιακό 5f διαθέτει επίσης έναν ακτινωτό κόμβο.
Μέγεθος
4f Τροχιακά: Τα τροχιακά 4f είναι μικρότερα από τα τροχιακά 5f.
5f Τροχιακά: Τα τροχιακά 5f είναι μεγαλύτερα από τα τροχιακά 4f.
Συμπέρασμα
Τα άτομα αποτελούνται από διαφορετικές μορφές τροχιακών στο φλοιό ηλεκτρονίων τους:τροχιακά s, τροχιακά p, d τροχιακά και f τροχιακά. Η προσθήκη ενός f τροχιακού ξεκινά από το κέλυφος των 4 ηλεκτρονίων (ενεργειακό επίπεδο). Η κύρια διαφορά μεταξύ των τροχιακών 4f και 5f είναι ότι τα τροχιακά 4f έχουν έναν αριθμό επιπέδων και κωνικών κόμβων, αλλά όχι ακτινωτούς κόμβους, ενώ το 5f έχει έναν αριθμό επιπέδων και κωνικών κόμβων και κάθε τροχιακό έχει επίσης έναν ακτινωτό κόμβο.
Αναφορά:
1. Mark J Winter. "Ατομικά τροχιακά:4f (Γενικό σύνολο)." The Orbitron:μια συλλογή ατομικών τροχιακών και μοριακών τροχιακών, 12 Ιουλίου 2015, Διαθέσιμο εδώ.
2. Mark J Winter. "Ατομικά τροχιακά:5f (Γενικό σύνολο)." The Orbitron:μια συλλογή ατομικών τροχιακών και μοριακών τροχιακών, 12 Ιουλίου 2015, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. "F τροχιακά m" Από Geek3 – Δική εργασία (CC BY-SA 3.0) μέσω Commons Wikimedia




