Ποια είναι μια μέθοδος που χρησιμοποιείται για τον προσδιορισμό του αριθμού και της θέσης των ηλεκτρονίων για συγκεκριμένα άτομα;
1. Ατομικός αριθμός:
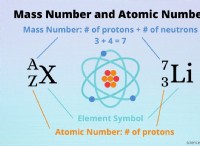
* Ο ατομικός αριθμός ενός στοιχείου σας λέει τον αριθμό των πρωτονίων στον πυρήνα του. Δεδομένου ότι τα άτομα είναι ηλεκτρικά ουδέτερα, ο αριθμός των πρωτονίων ισούται επίσης με τον αριθμό των ηλεκτρονίων.
2. Κεφάλαια ηλεκτρονίων και υποβρύχια:
* Τα ηλεκτρόνια είναι οργανωμένα σε επίπεδα ενέργειας που ονομάζονται κοχύλια . Κάθε κέλυφος διαιρείται περαιτέρω σε subshells με διαφορετικά σχήματα και επίπεδα ενέργειας (S, P, D, και F).
* Ο αριθμός των ηλεκτρονίων που μπορεί να διατηρηθεί κάθε υποβρύχια καθορίζεται από το συγκεκριμένο επίπεδο και το επίπεδο ενέργειας:
* Subshell: κρατά έως 2 ηλεκτρόνια
* pubshell: κρατά έως 6 ηλεκτρόνια
* d Subshell: κρατά μέχρι 10 ηλεκτρόνια
* f Subshell: κρατά μέχρι 14 ηλεκτρόνια
3. Γεμίζοντας τα κελύφη και τα υποκείμενα:
* Τα ηλεκτρόνια γεμίζουν τα κελύφη και τα υποβρύχια μετά από συγκεκριμένους κανόνες:
* Αρχή Aufbau: Τα ηλεκτρόνια γεμίζουν πρώτα τα χαμηλότερα επίπεδα ενέργειας.
* Κανόνας Hund: Μέσα σε ένα υποβρύχιο, τα ηλεκτρόνια θα καταλαμβάνουν τροχιακά μεμονωμένα πριν από τη σύζευξη.
* Αρχή αποκλεισμού Pauli: Κανένα δύο ηλεκτρόνια σε ένα άτομο δεν μπορεί να έχει το ίδιο σύνολο τεσσάρων κβαντικών αριθμών (συμπεριλαμβανομένης της περιστροφής).
4. Σημειώσεις διαμόρφωσης ηλεκτρονίων:
* Η διαμόρφωση ηλεκτρονίων είναι γραμμένη χρησιμοποιώντας μια σημείωση στενογραφίας. Για παράδειγμα, η διαμόρφωση ηλεκτρονίων του αζώτου (ατομικός αριθμός 7) είναι:
* 1S²2S2P3P³
* Αυτό σημαίνει ότι υπάρχουν 2 ηλεκτρόνια στο 1S Subshell, 2 ηλεκτρόνια στο 2S Subshell και 3 ηλεκτρόνια στο 2p subshell.
5. Διαγράμματα τροχιάς:
* Τα τροχιακά διαγράμματα είναι μια πιο οπτική αναπαράσταση της διαμόρφωσης ηλεκτρονίων. Χρησιμοποιούν κουτιά για να αντιπροσωπεύουν τροχιακά και βέλη για να αντιπροσωπεύουν ηλεκτρόνια.
Παράδειγμα:
Ας δούμε το οξυγόνο (ατομικός αριθμός 8):
* Ατομικός αριθμός: 8, που σημαίνει ότι έχει 8 ηλεκτρόνια.
* Διαμόρφωση ηλεκτρονίων: 1S²2S²2P⁴
* Το 2p subshell έχει 4 ηλεκτρόνια, οπότε θα έχει ένα τροχιακό με 2 ηλεκτρόνια και δύο τροχιακά με 1 ηλεκτρόνιο το καθένα.
* Orbital Diagram:
* 1S:↑ ❖
* 2S:↑ ❖
* 2p:↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑
Χρησιμοποιώντας διαμόρφωση ηλεκτρονίων και τροχιακά διαγράμματα, μπορείτε να καθορίσετε τον αριθμό και τη θέση των ηλεκτρονίων για οποιοδήποτε δεδομένο άτομο. Αυτές οι πληροφορίες είναι ζωτικής σημασίας για την κατανόηση των χημικών ιδιοτήτων ενός στοιχείου και τον τρόπο με τον οποίο θα αλληλεπιδράσει με άλλα άτομα.