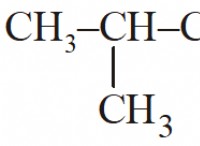Ένα υδατικό διάλυμα που περιέχει μια μη πτητική διαλυτή ουσία θα βράσει πάνω από 100 Κελσίου σε πίεση 1 atm αληθής ή ψευδής;
Εδώ είναι γιατί:
* Ανύψωση σημείου βρασμού: Όταν μια μη πτητική ουσία (μία που δεν εξατμίζεται εύκολα) προστίθεται σε έναν διαλύτη (όπως το νερό), διαταράσσει την πίεση ατμών του διαλύτη. Τα μόρια διαλυτής ουσίας παρεμποδίζουν τα μόρια του διαλύτη που διαφεύγουν στην αέρια φάση.
* Απαιτείται υψηλότερη πίεση ατμών: Για να φτάσετε στο σημείο βρασμού (όπου η πίεση ατμών ισούται με την ατμοσφαιρική πίεση), το διάλυμα χρειάζεται τώρα υψηλότερη θερμοκρασία. Αυτό οφείλεται στο γεγονός ότι η παρουσία της διαλελυμένης ουσίας έχει μειώσει την πίεση ατμών του διαλύτη.
* 1 atm: Σε μια τυπική πίεση 1 ατμόσφαιρας, το καθαρό νερό βράζει στους 100 βαθμούς Κελσίου. Ωστόσο, το διάλυμα θα πρέπει να φτάσει σε θερμοκρασία πάνω από 100 βαθμούς Κελσίου για να επιτευχθεί η ίδια πίεση ατμών και να βράσει.
Επιτρέψτε μου να ξέρω αν θέλετε περισσότερες λεπτομέρειες σχετικά με την ανύψωση του σημείου βρασμού!