Διαφορά μεταξύ αλκανίων και αλκενίων
Κύρια διαφορά – Αλκάνια vs Αλκένια
Οι υδρογονάνθρακες είναι ενώσεις που αποτελούνται από άτομα C και H. Αυτά τα μόρια υδρογονάνθρακα έχουν διαφορετικούς συνδυασμούς ατόμων C και H και έχουν διαφορετικές γεωμετρίες ανάλογα με τη χωρική διάταξη των μορίων. Δεδομένου ότι χιλιάδες υδρογονάνθρακες έχουν ανακαλυφθεί μέχρι στιγμής, υπάρχουν διαφορετικές ταξινομήσεις για αυτές τις ενώσεις. Τα αλκάνια και τα αλκένια είναι τέτοιες δύο κατηγορίες. Και οι δύο αυτοί τύποι υδρογονανθράκων αποτελούνται από διακλαδισμένους, μη διακλαδισμένους και κυκλικούς υδρογονάνθρακες. Η κύρια διαφορά μεταξύ των αλκανίων και των αλκενίων είναι ότι τα αλκάνια είναι κορεσμένοι υδρογονάνθρακες ενώ τα αλκένια είναι ακόρεστοι υδρογονάνθρακες.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα Αλκάνια
– Ορισμός, Ονοματολογία, Ιδιότητες και Αντιδράσεις
2. Τι είναι τα Αλκένια
– Ορισμός, Ονοματολογία, Ιδιότητες και Αντιδράσεις
3. Ποιες είναι οι ομοιότητες μεταξύ των αλκανίων και των αλκενίων
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ των αλκανίων και των αλκενίων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αλειφατικά, αλκάνια, αλκένια, διακλαδισμένα αλκάνια, αργό πετρέλαιο, κυκλικά αλκάνια, υδρογονάνθρακες, γραμμικά αλκάνια , φυσικό αέριο, κορεσμένοι υδρογονάνθρακες, ακόρεστοι υδρογονάνθρακες 
Τι είναι τα Αλκάνια
Τα αλκάνια είναι κορεσμένοι υδρογονάνθρακες που έχουν τον χημικό τύπο Cn H2n+2 (όπου n είναι ένας ακέραιος αριθμός). Τα αλκάνια ονομάζονται υδρογονάνθρακες επειδή αποτελούνται από άτομα C και H. Όλα αυτά τα άτομα συνδέονται μεταξύ τους μέσω απλών ομοιοπολικών δεσμών. Δεδομένου ότι δεν υπάρχουν διπλοί ή τριπλοί δεσμοί, τα αλκάνια ονομάζονται κορεσμένοι υδρογονάνθρακες.
Τα αλκάνια είναι μια ευρεία ομάδα οργανικών μορίων. Ονομάζονται σύμφωνα με τον αριθμό των ατόμων άνθρακα και τις πλευρικές ομάδες από τις οποίες αποτελούνται. Το μικρότερο αλκάνιο είναι το μεθάνιο. Στο μεθάνιο, ένα κεντρικό άτομο άνθρακα συνδέεται με 4 άτομα υδρογόνου. Η ονοματολογία IUPAC των αλκανίων βασίζεται σε ελληνικά προθέματα. Μερικά παραδείγματα δίνονται στον παρακάτω πίνακα.
| Χημικός τύπος | άτομα άνθρακα σε ένα μόριο | Χρησιμοποιήθηκε το ελληνικό πρόθεμα | Όνομα του Αλκανίου |
| CH4 | 1 | μέθ- | Μεθάνιο |
| C2 H6 | 2 | eth- | Αιθάνιο |
| C3 H8 | 3 | Στήριγμα- | Προπάνιο |
| C4 H10 | 4 | Αλλά- | Βουτάνιο |
| C5 H12 | 5 | Pent- | Πεντάνιο |
Σύμφωνα με τη δομή των αλκανίων, υπάρχουν τρεις κύριοι τύποι αλκανίων. Είναι;
- Γραμμικά αλκάνια
- Διακλαδισμένα αλκάνια
- Κυκλικά αλκάνια
Γραμμικά αλκάνια είναι αλκάνια ευθείας αλυσίδας που δεν έχουν πλευρικές ομάδες συνδεδεμένες με το μόριο αλκανίου. Διακλαδισμένα αλκάνια είναι μόρια που έχουν ομάδες αλκυλίου ως πλευρικές ομάδες, αλλά είναι κορεσμένα μόρια. Οι αλκυλομάδες είναι αλκάνια που στερούνται ενός ατόμου υδρογόνου, άρα έχουν ένα κενό σημείο για να προσκολληθούν σε ένα άτομο άνθρακα. Κυκλικά αλκάνια είναι δομές δακτυλίου.
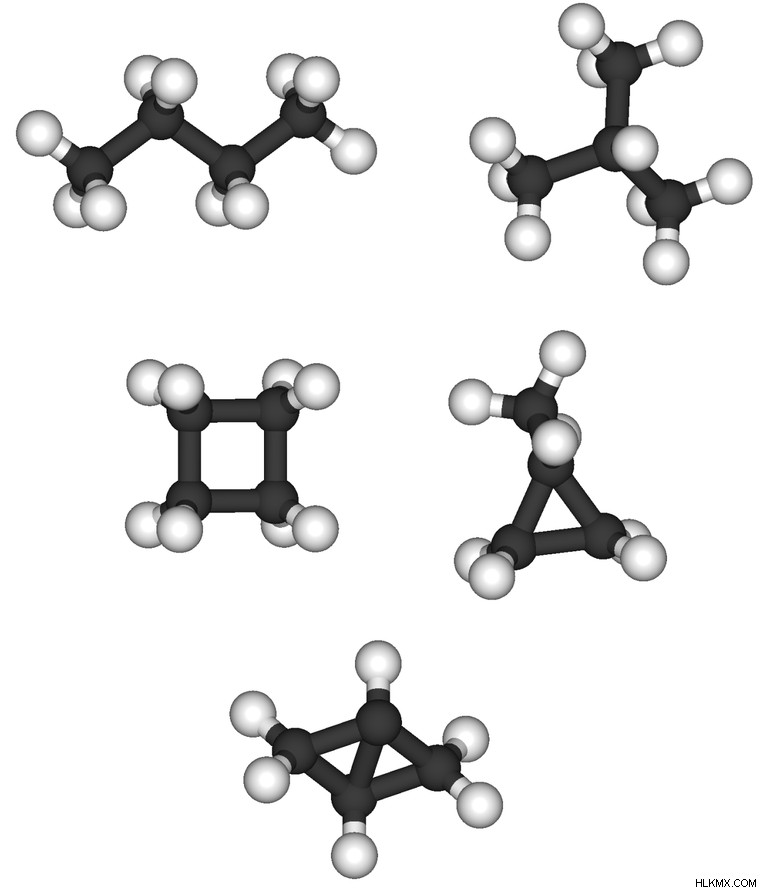
Εικόνα 1:Διαφορετικές μορφές αλκανίων
Οι κύριες πηγές αλκανίων είναι το αργό πετρέλαιο και τα φυσικά αέρια. Αυτά τα καύσιμα αποτελούνται κυρίως από μόρια αλκανίων. Επομένως μπορούμε να λάβουμε αλκάνια μέσω της διύλισης πετρελαίου. Μια διαδικασία που ονομάζεται κλασματική απόσταξη διαχωρίζει αυτά τα αλκάνια.
Όλα τα αλκάνια είναι άχρωμα και άοσμα. Τα σημεία τήξης και βρασμού αυξάνονται με την αύξηση του αριθμού των ατόμων άνθρακα. Κάτω από τυπικές συνθήκες θερμοκρασίας και πίεσης, ορισμένα αλκάνια είναι υγρά και μερικά είναι αέριες ενώσεις. Αυτή η διαφορά οφείλεται στα διαφορετικά σημεία βρασμού τους. Τα αλκάνια παρουσιάζουν ισομέρεια. Ένα μόριο αλκανίου μπορεί να έχει δομικό ισομερισμό ή στερεοϊσομερισμό ανάλογα με τη δομή του και τη χωρική διάταξη του μορίου.
Μία από τις σημαντικότερες αντιδράσεις που υφίστανται τα αλκάνια είναι η αντίδραση της καύσης. Η καύση των αλκανίων περιλαμβάνει την αντίδραση μεταξύ αλκανίου και μοριακού οξυγόνου. Αυτή η αντίδραση παράγει διοξείδιο του άνθρακα, νερό και θερμότητα. Επιπλέον, τα αλκάνια μπορούν να υποστούν αντιδράσεις αλογόνωσης. Εκεί, μόρια όπως το Cl2 αντιδρούν με αλκάνια όταν παρέχεται επαρκής ενέργεια. Αυτή η αντίδραση παράγει αλκυλαλογονίδια.
Τι είναι τα Αλκένια
Τα αλκένια είναι ακόρεστοι υδρογονάνθρακες που έχουν τον χημικό τύπο Cn H2n . Αυτοί ονομάζονται υδρογονάνθρακες επειδή τα αλκένια αποτελούνται μόνο από άτομα C και H. Ονομάζονται ακόρεστα επειδή αποτελούνται από τουλάχιστον έναν διπλό δεσμό C=C. Επομένως, δεν μπορεί να υπάρχει αλκένιο με ένα μόνο άτομο άνθρακα. Το απλούστερο αλκένιο είναι το C2 H4 . Τα μικρά αλκένια είναι αέρια σε θερμοκρασία δωματίου. Άλλα αλκένια είναι υγρά. Αλλά τα αλκένια που έχουν πολύ μεγάλο αριθμό ατόμων άνθρακα βρίσκονται σε κηρώδη στερεά κατάσταση.
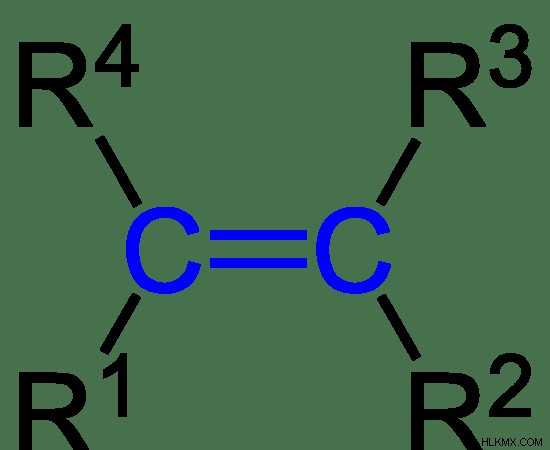
Εικόνα 2:Γενική δομή των αλκενίων
Στην παραπάνω εικόνα, τα R1, R2, R3 και R4 είναι ομάδες αλκυλίου που μπορεί να είναι πανομοιότυπες ή διαφορετικές μεταξύ τους.
Ένα αλκένιο μπορεί να έχει έναν ή περισσότερους διπλούς δεσμούς. Τις περισσότερες φορές, αυτοί οι διπλοί δεσμοί διατάσσονται με εναλλακτικό τρόπο. Τα αλκένια είναι άχρωμα και μη πολικά. Τα αλκένια θεωρούνται ως αντιδραστικά μόρια λόγω της παρουσίας διπλού δεσμού. Αυτός ο διπλός δεσμός αποτελείται από έναν δεσμό σίγμα και έναν δεσμό pi. Αυτός ο δεσμός pi μπορεί να διασπαστεί. Αυτό ονομάζεται άνοιγμα του διπλού δεσμού. Στη συνέχεια, τα ηλεκτρόφιλα μπορούν να προσκολληθούν σε αυτά τα άτομα άνθρακα που ήταν σε διπλό δεσμό. Αυτές ονομάζονται αντιδράσεις προσθήκης αλκενίων.
Επιπλέον, ο πολυμερισμός είναι μια σημαντική αντίδραση στην οποία μπορούν να υποστούν τα αλκένια. Το άνοιγμα του διπλού δεσμού επιτρέπει στα αλκένια να υποστούν πολυμερισμό. Εδώ, ένα μόριο αλκενίου ονομάζεται μονομερές. Αυτό οδηγεί στην παραγωγή πολύ σημαντικών πολυμερών.
Τα αλκένια δείχνουν γεωμετρικό ισομερισμό. Αυτό ονομάζεται επίσης ισομερισμός cis-trans. Όταν ονομάζουμε ένα αλκένιο, θα πρέπει επίσης να λάβουμε υπόψη τη γεωμετρία cis-trans αυτών των μορίων.
Similarities Between Alkanes and Alkenes">Similarities Between Alkanes and Alkenes
- Τα αλκάνια και τα αλκένια είναι υδρογονάνθρακες.
- Τα μικρά μόρια αλκανίου και τα μικρά μόρια αλκενίου είναι αέρια σε θερμοκρασία δωματίου.
- Τα άτομα στα αλκάνια και τα αλκένια συνδέονται μεταξύ τους μέσω ομοιοπολικών δεσμών.
- Και τα δύο είναι μη πολικά μόρια.
- Επομένως και τα δύο είναι αδιάλυτα στο νερό και σε άλλους πολικούς διαλύτες.
- Τόσο τα αλκάνια όσο και τα αλκένια μπορούν να καούν για να σχηματίσουν θερμότητα μαζί με διοξείδιο του άνθρακα και υδρατμούς.
Διαφορά μεταξύ αλκανίων και αλκενίων
Ορισμός
Αλκάνια: Τα αλκάνια είναι κορεσμένοι υδρογονάνθρακες που έχουν τον χημικό τύπο Cn H2n+2.
Αλκένια: Τα αλκένια είναι ακόρεστοι υδρογονάνθρακες που έχουν τον χημικό τύπο Cn H2n .
Χημικός δεσμός
Αλκάνια: Τα αλκάνια αποτελούνται μόνο από απλούς δεσμούς.
Αλκένια: Τα αλκένια αποτελούνται από διπλούς δεσμούς καθώς και από απλούς δεσμούς.
Χημικός τύπος
Αλκάνια: Ο χημικός τύπος για τα αλκάνια είναι Cn H2n+2 .
Αλκένια: Ο χημικός τύπος για τα αλκένια είναι Cn H2n .
Πολυμερισμός
Αλκάνια: Τα αλκάνια δεν μπορούν να υποστούν πολυμερισμό.
Αλκένια: Τα αλκένια μπορούν να υποστούν πολυμερισμό.
Δεσμοί Pi
Αλκάνια: Τα αλκάνια δεν έχουν δεσμούς pi.
Αλκένια: Τα αλκένια αποτελούνται από δεσμούς pi.
Συμπέρασμα
Τα αλκάνια και τα αλκένια είναι σημαντικοί υδρογονάνθρακες. Αν και υπάρχουν ομοιότητες μεταξύ των αλκανίων και των αλκενίων, όπως η μη πολική συμπεριφορά και η αδιαλυτότητα στο νερό, έχουν πολλά διακριτά χαρακτηριστικά. Η κύρια διαφορά μεταξύ των αλκανίων και των αλκενίων είναι ότι τα αλκάνια είναι κορεσμένοι υδρογονάνθρακες ενώ τα αλκένια είναι ακόρεστοι υδρογονάνθρακες.