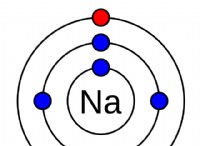
Τι διακρίνει ένα στοιχείο από το άλλο;
Εδώ είναι γιατί:
* Τα πρωτόνια καθορίζουν την ταυτότητα του στοιχείου: Τα πρωτόνια είναι θετικά φορτισμένα σωματίδια που βρίσκονται στον πυρήνα ενός ατόμου. Είναι τα θεμελιώδη δομικά στοιχεία ενός στοιχείου και ο αριθμός τους ορίζει τις χημικές του ιδιότητες.
* Ο ατομικός αριθμός είναι σταθερός: Για ένα δεδομένο στοιχείο, ο αριθμός των πρωτονίων δεν αλλάζει ποτέ. Αυτός είναι ο λόγος για τον οποίο ο ατομικός αριθμός χρησιμοποιείται για την οργάνωση του περιοδικού πίνακα.
* Άλλα σωματίδια μπορεί να ποικίλουν: Ενώ ο αριθμός των πρωτονίων είναι σταθερός για ένα στοιχείο, ο αριθμός των νετρονίων και των ηλεκτρονίων μπορεί να ποικίλει. Αυτό οδηγεί στην ύπαρξη ισοτόπων (άτομα του ίδιου στοιχείου με διαφορετικούς αριθμούς νετρονίων) και ιόντα (άτομα που έχουν κερδίσει ή χαμένα ηλεκτρόνια).
Παράδειγμα:
* Το υδρογόνο (Η) έχει 1 πρωτόνιο.
* Το ήλιο (He) έχει 2 πρωτόνια.
* Ο άνθρακας (C) έχει 6 πρωτόνια.
Παρόλο που τα ισότοπα του άνθρακα όπως ο άνθρακας-12 και ο άνθρακας-14 έχουν διαφορετικούς αριθμούς νετρονίων, εξακολουθούν να είναι και οι δύο άνθρακα επειδή έχουν τον ίδιο αριθμό πρωτονίων (6).