Γιατί μπορεί το άζωτο και το οξυγόνο να σχηματίσουν αρκετές διαφορετικές ενώσεις;
* Μεταβλητή σθένος: Τόσο το άζωτο όσο και το οξυγόνο μπορούν να παρουσιάσουν πολλαπλές καταστάσεις οξείδωσης (Valencies). Το άζωτο μπορεί να έχει βαλβίδες -3, -2, -1, +1, +2, +3, +4 και +5, ενώ το οξυγόνο τυπικά έχει βαλβίδες -2 και -1. Αυτό επιτρέπει ένα ευρύ φάσμα πιθανών συνδυασμών.
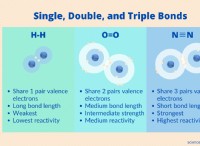
* Πολλαπλές δυνατότητες συγκόλλησης: Το άζωτο και το οξυγόνο μπορούν να σχηματίσουν μονό, διπλό και τριπλό δεσμό μεταξύ τους. Αυτό προσθέτει περαιτέρω πολυπλοκότητα στους τύπους ενώσεων που μπορούν να σχηματιστούν.
* Διαφορετικές μοριακές γεωμετρίες: Τα άτομα σε αυτά τα μόρια μπορούν να εγκατασταθούν σε διαφορετικές γεωμετρικές διαμορφώσεις (π.χ. γραμμική, λυγισμένη, τριγωνική επίπεδη, τετραεδρική), διαφοροποιώντας περαιτέρω τις πιθανές ενώσεις.
* Διαφορετικοί αριθμοί ατόμων: Ο αριθμός των ατόμων και των ατόμων οξυγόνου σε μια ένωση μπορεί να ποικίλει, οδηγώντας σε μια σειρά μοριακών τύπων. Για παράδειγμα, υπάρχουν οξείδια αζώτου όπως το Ν2Ο (νιτρώδες οξείδιο), ΝΟ (νιτρικό οξείδιο), ΝΟ2 (διοξείδιο του αζώτου) και Ν2Ο4 (τετροξείδιο Dinitrogen).
* Παρουσία άλλων στοιχείων: Εκτός από το άζωτο και το οξυγόνο, οι ενώσεις μπορούν επίσης να περιλαμβάνουν άλλα στοιχεία, επεκτείνοντας περαιτέρω τις δυνατότητες. Για παράδειγμα, το νιτρώδες οξύ (HNO2) και το νιτρικό οξύ (HNO3) περιέχουν επίσης υδρογόνο.
Παραδείγματα ενώσεων αζώτου-οξυγόνου:
* Οξείδια αζώτου: N2O, NO, NO2, N2O4, N2O5
* Νιτρικό οξύ: HNO3
* νιτρώδες οξύ: HNO2
* Διοξείδιο του αζώτου: NO2
* οξείδιο του αζώτου: N2O
Ο συνδυασμός αυτών των παραγόντων οδηγεί σε μια ποικιλία ενώσεων αζώτου-οξυγόνου με ποικίλες ιδιότητες και εφαρμογές.