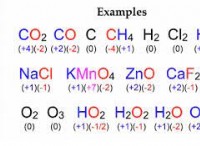
Εάν μια ουσία υποβληθεί σε αλλαγή φάσης, τι συμβαίνει;
Τι συμβαίνει κατά τη διάρκεια μιας αλλαγής φάσης:
* Μεταφορά ενέργειας: Οι αλλαγές φάσης περιλαμβάνουν πάντα είτε την απορρόφηση είτε την απελευθέρωση ενέργειας.
* Απορρόφηση: Όταν μια ουσία απορροφά την ενέργεια (όπως η θερμότητα), τα μόρια της κινούνται ταχύτερα και απομακρύνονται από τους δεσμούς τους, προκαλώντας μια αλλαγή φάσης σε μια λιγότερο πυκνή κατάσταση (στερεό σε υγρό, υγρό σε αέριο).
* Απελευθέρωση: Όταν μια ουσία απελευθερώνει ενέργεια, τα μόρια της επιβραδύνουν και δεσμεύονται πιο έντονα, οδηγώντας σε μια αλλαγή φάσης σε μια πυκνότερη κατάσταση (αέριο σε υγρό, υγρό σε στερεό).
* Αλλαγές στις φυσικές ιδιότητες:
* Πυκνότητα: Τα στερεά είναι πυκνότερα από τα υγρά και τα υγρά είναι πυκνότερα από τα αέρια.
* Σχήμα: Τα στερεά έχουν σταθερό σχήμα, τα υγρά παίρνουν το σχήμα του δοχείου τους και τα αέρια γεμίζουν το δοχείο τους εντελώς.
* Όγκος: Ο όγκος μιας ουσίας μπορεί να αλλάξει κατά τη διάρκεια μιας αλλαγής φάσης. Για παράδειγμα, το νερό επεκτείνεται όταν παγώνει.
Τύποι αλλαγών φάσης:
* τήξη: Στερεό σε υγρό (απορρόφηση ενέργειας)
* κατάψυξη: Υγρό έως στερεό (απελευθέρωση ενέργειας)
* Εξάτμιση: Υγρό σε αέριο (απορρόφηση ενέργειας)
* συμπύκνωση: Φυσικό αέριο σε υγρό (απελευθέρωση ενέργειας)
* εξάχνωση: Στερεό σε αέριο (απορρόφηση ενέργειας)
* εναπόθεση: Φυσικό αέριο σε στερεό (απελευθέρωση ενέργειας)
Παράδειγμα:
Φανταστείτε ένα μπλοκ πάγου (στερεό νερό) στους 0 ° C. Εάν προσθέσετε θερμότητα, ο πάγος θα λιώσει και θα γίνει υγρό νερό. Αυτό οφείλεται στο γεγονός ότι η θερμική ενέργεια αναγκάζει τα μόρια του νερού να μετακινούνται γρηγορότερα και να απαλλαγούν από την άκαμπτη δομή τους. Εάν συνεχίσετε να προσθέτετε θερμότητα, το υγρό νερό τελικά θα βράσει και θα γίνει υδρατμός (αέριο).
Βασικά σημεία:
* Οι αλλαγές φάσης είναι φυσικές αλλαγές , όχι χημικές αλλαγές. Η χημική σύνθεση της ουσίας παραμένει η ίδια.
* Οι αλλαγές φάσης είναι αναστρέψιμες . Μπορείτε να αλλάξετε μια ουσία πίσω στην αρχική του κατάσταση προσθέτοντας ή αφαιρώντας ενέργεια.
* Οι αλλαγές φάσης είναι σημαντικές σε πολλές φυσικές διεργασίες, όπως ο κύκλος του νερού και τα πρότυπα καιρού.