Πώς να βρείτε τον αριθμό οξείδωσης και την κατάσταση οξείδωσης
Αριθμός οξείδωσης και κατάσταση οξείδωσης είναι δύο πολύ σημαντικές έννοιες στη χημεία. Σε αυτό το άρθρο, θα τα κάνουμε πολύ εύκολα κατανοητά!
Καλύπτεται σε άλλα άρθρα:
Κατιόντα και Ιόντα
Αντιδράσεις οξειδοαναγωγής
Κοινά πολυατομικά ιόντα
Ηλεκτροχημικά κύτταρα
Τι είναι τα ιόντα;
Αριθμός οξείδωσης – Ορισμός
Ο αριθμός οξείδωσης αντιπροσωπεύει πόσα ηλεκτρόνια έχει αποκτήσει ή χάσει ένα άτομο σε ένα μόριο. Τα στοιχεία έχουν κατάσταση οξείδωσης μηδέν και τα άτομα στις ιοντικές ενώσεις συνήθως αποδίδονται σε θετική ή αρνητική κατάσταση οξείδωσης. Οι οργανικές ενώσεις και ορισμένες ομοιοπολικές ενώσεις δεν έχουν καταστάσεις οξείδωσης που εκχωρούνται στα άτομα των ενώσεων.
Με άλλα λόγια, η κατάσταση οξείδωσης ενός ατόμου είναι ίση με τον αριθμό των ηλεκτρονίων που έχουν αφαιρεθεί από ένα στοιχείο (παράγοντας μια θετική κατάσταση οξείδωσης) ή έχουν προστεθεί σε ένα στοιχείο (παράγοντας μια αρνητική κατάσταση οξείδωσης).
Εάν θέλετε να χρησιμοποιήσετε τον ορισμό IUPAC, ορίστε:«Κατάσταση οξείδωσης ενός ατόμου είναι το φορτίο αυτού του ατόμου μετά από ιοντική προσέγγιση των ετεροπυρηνικών δεσμών του "
Κατάσταση οξείδωσης – Ορισμός
Η κατάσταση οξείδωσης ενός ατόμου είναι απλώς ο αριθμός οξείδωσής του. Δεν υπάρχει διαφορά.
(*Διαβάστε την τελευταία ενότητα του άρθρου για να μάθετε για μια εξαίρεση)
Πώς να βρείτε τον Αριθμό Οξείδωσης
Χρησιμοποιώντας μερικούς απλούς κανόνες, μπορείτε εύκολα να προσδιορίσετε τον αριθμό οξείδωσης κάθε ατόμου σε ένα μόριο.
Κανόνες αριθμών οξείδωσης
Χρησιμοποιήστε αυτούς τους κανόνες για να προσδιορίσετε την κατάσταση οξείδωσης κάθε ατόμου σε μια ένωση.
- Το φθόριο είναι πάντα -1.
- Το οξυγόνο είναι πάντα -2, εκτός εάν είναι με φθόριο ή όταν είναι σε υπεροξείδιο ή υπεροξυ ανιόν όπως το ιόν υπεροξειδίου, οπότε είναι -1.
- Η κατάσταση οξείδωσης ενός ατόμου στη στοιχειακή του κατάσταση είναι μηδέν. Για παράδειγμα, He, O2 , S8
- Σε μια ιοντική ένωση με 2 στοιχεία, το μέταλλο ή το πιο ηλεκτραρνητικό άτομο έχει θετικό αριθμό οξείδωσης και το μη μέταλλο ή λιγότερο ηλεκτραρνητικό άτομο έχει αρνητικό αριθμό οξείδωσης.
- Μέταλλα αλκαλίων (μέταλλα της ομάδας 1) όπως το νάτριο και το κάλιο έχουν κατάσταση οξείδωσης +1
- Τα μέταλλα των αλκαλικών γαιών (μέταλλα της ομάδας 2) όπως το ασβέστιο και το μαγνήσιο είναι +2
- Το υδρογόνο είναι +1 όταν συνδυάζεται με ένα μη μέταλλο, για παράδειγμα υδροχλώριο HCL. Είναι -1 όταν συνδυάζεται με ένα μέταλλο – για παράδειγμα υδρίδιο του νατρίου, NaH.
- Τα αλογόνα έχουν αριθμό οξείδωσης -1 όταν συνδυάζονται με ένα άλλο στοιχείο (δυαδικές ενώσεις), εκτός από τις ενώσεις μεταξύ αλογόνων. Για παράδειγμα, φθοριούχο νάτριο NaF, ιωδιούχο ασβέστιο CaI2 , χλωριούχο χρώμιο (III) CrCl3 , βρωμιούχο κασσίτερο (II) SnBr2 . Σε κάθε περίπτωση, το αλογόνο έχει αριθμό οξείδωσης -1.
- Το φορτίο ενός μονοατομικού ιόντος (ιόντος που αποτελείται από 1 τύπο ατόμου) μπορεί να σας πει την κατάσταση οξείδωσης. Για παράδειγμα, η κατάσταση οξείδωσης του χαλκού σε μια ένωση χαλκού (II) είναι +2. Ο υδράργυρος στο ιόν υδραργύρου (Hg2 ) είναι +1 (πρέπει να διαιρέσετε τη χρέωση με το 2 σε αυτήν την περίπτωση). Το άζωτο είναι -3 στο ιόν νιτριδίου, N
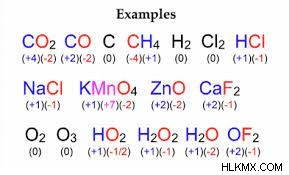
- Σε ένα πολυατομικό ιόν, το άθροισμα των καταστάσεων οξείδωσης των μεμονωμένων ατόμων πρέπει να είναι ίσο με το φορτίο του ιόντος. Εάν υπάρχει οξυγόνο, υποθέστε ότι το οξυγόνο είναι -2. Δημιουργήσαμε ένα βίντεο για να εξηγήσουμε πώς γίνεται αυτό.
Παραδείγματα αριθμού οξείδωσης του κανόνα 10:
Για παράδειγμα, στο νιτρικό ιόν NO3 , το φορτίο του ιόντος είναι -1. Χρησιμοποιώντας τον κανόνα 2, γνωρίζουμε ότι το φορτίο των οξυγόνων είναι 3 x-2 =-6. Άρα το άζωτο πρέπει να έχει φορτίο +5 για να γίνει το φορτίο του ιόντος -1.
Το ιόν χλωρίτη, ClO2-, έχει φορτίο -1. Χρησιμοποιώντας τον κανόνα 2, γνωρίζουμε ότι το φορτίο των οξυγόνων είναι 2 x -2 =-4. Άρα το χλώριο πρέπει να έχει φορτίο +3 για να γίνει το φορτίο του ιόντος χλωρίτη -1.
Στοιχεία με τις περισσότερες καταστάσεις οξείδωσης
Το βανάδιο, το μαγγάνιο και το χρώμιο έχουν τη μεγαλύτερη ποικιλία σταθερών καταστάσεων οξείδωσης και χρωμάτων. Η φωτογραφία εξωφύλλου αυτού του άρθρου, που τραβήχτηκε από τον Wilco Oelen (ο οποίος ήταν μια από τις πολλές εμπνεύσεις για το ChemTalk), δείχνει τα χρώματα των ενώσεων του βαναδίου στις καταστάσεις οξείδωσης +2, +3, +4 και +5. Το βολφράμιο και το μολυβδαίνιο έχουν επίσης αρκετές καταστάσεις οξείδωσης, μερικές από τις οποίες έχουν μελετηθεί λιγότερο από άλλα μέταλλα μετάπτωσης.
Διασκεδαστικό γεγονός – η υψηλότερη γνωστή κατάσταση οξείδωσης αναφέρεται ότι είναι +9 στο κατιόν τετροξοιρίδιο (IX) (IrO4 ).
Ποια είναι η κατάσταση οξείδωσης και ο αριθμός του θείου στο Τετραθειονικό ιόν;
Στο τετραθειονικό ιόν, S4 O6 , δύο από τα θεία έχουν κατάσταση οξείδωσης 0, και δύο έχουν κατάσταση οξείδωσης +5. Ο «μέσος» αριθμός οξείδωσης του θείου στο μόριο είναι (0+0+5+5)/4 =2,5. Μόνο σε αυτές τις ενώσεις μεικτής κατάστασης οξείδωσης μπορεί να προκύψει η έννοια του διαφορετικού αριθμού οξείδωσης από την κατάσταση οξείδωσης




