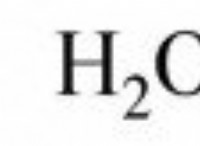Γιατί το φωσφορικό διϋδρογόνο του καλίου και το υδρογόνο διπλοασίου έχουν διαφορετικές τιμές ρΗ;
Εδώ είναι μια κατανομή:
* kh₂po₄ (φωσφορικό διϋδρογόνο κάλιο):
* Αυτό το αλάτι είναι όξινο χαρακτήρα.
* Σχηματίζεται από μια ισχυρή βάση (KOH) και ένα αδύναμο οξύ (H₃po₄).
* Σε διάλυμα, απελευθερώνει ιόντα Η ς λόγω της μερικής διάστασης του ιόντος φωσφορικού διυδρογόνου (H₂po₄⁻).
* Τα απελευθερωμένα ιόντα Η που συμβάλλει σε χαμηλότερο ρΗ (όξινο).
* k₂hpo₄ (φωσφορικό υδρογόνο dipotassium):
* Αυτό το αλάτι είναι βασικό στη φύση.
* Σχηματίζεται από μια ισχυρή βάση (KOH) και ένα αδύναμο οξύ (H₃po₄).
* Σε διάλυμα, απελευθερώνει ιόντα ΟΗΧ λόγω της μερικής διάστασης του ιόντος φωσφορικού υδρογόνου (HPO₄2⁻).
* Τα απελευθερωμένα ιόντα OHON συμβάλλουν σε υψηλότερο ρΗ (βασικό).
Η βασική διαφορά:
Η διαφορά στις τιμές του ρΗ τους προέρχεται από τα σχετικά πλεονεκτήματα των ζευγών συζευγμένων οξέων-βάσης που εμπλέκονται.
* kh₂po₄: Το ιόν H₂po₄⁻ είναι ένα ισχυρότερο οξύ από το ιόν Hpo₄²⁻, έτσι δίνει περισσότερα ιόντα Η, οδηγώντας σε χαμηλότερο ρΗ.
* k₂hpo₄: Το ιόν Hpo₄²⁻ είναι μια ισχυρότερη βάση από το ιόν H₂po₄⁻, έτσι δέχεται περισσότερα ιόντα Η (ή δωρίζει περισσότερα ιόντα ΟΗ), οδηγώντας σε υψηλότερο ρΗ.
Συνοπτικά:
Το ρΗ των διαλυμάτων αυτών των αλάτων επηρεάζεται από τα σχετικά πλεονεκτήματα των ζευγών συζευγμένων οξέων οξέος που εμπλέκονται στη διάστασή τους. Το kh₂po₄ είναι όξινο λόγω του ισχυρότερου συστατικού οξέος, ενώ το k₂hpo₄ είναι βασικό λόγω του ισχυρότερου συστατικού βάσης.