Μονοπρωτικό, Τριπρωτικό και Πολυπρωτικό οξύ
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε τους ορισμούς του μονοπρωτικού, διπρωτικού, τριπρωτικού και πολυπρωτικού οξέος. Θα μάθετε επίσης για τις τάσεις της οξύτητας μεταξύ διαφορετικών οξέων, μεταξύ πρωτονίων εντός πολυπρωτικών οξέων και καμπυλών τιτλοδότησης πολυπρωτικού οξέος.
Θέματα που καλύπτονται σε άλλα άρθρα
- Χημεία οξέων βάσεων
- Ισχυρά οξέα/βάσεις
- Ασθενή οξέα/βάσεις
- Ιδιότητες οξέων και βάσεων
- Καμπύλες τιτλοδότησης
Λεξιλόγιο
Πρωτόνιο :Σε αυτό το πλαίσιο, ένα πρωτόνιο είναι ένα άτομο υδρογόνου του οποίου το ηλεκτρόνιο έχει αφαιρεθεί (ιόν υδρογόνου). Συμβολίζεται επίσης H.
Bronsted-Lowry acid :Ένας δότης πρωτονίου (Η).
Βάση Bronsted-Lowry :Ένας δέκτης πρωτονίων (Η).
Ka :η σταθερά ισορροπίας για μια αντίδραση αποπρωτονίωσης οξέος (στην κατεύθυνση προς τα εμπρός).
Τι είναι τα μονοπρωτικά οξέα;
Τα περισσότερα οξέα που παρατηρούνται συνήθως είναι μονοπρωτικά, που σημαίνει ότι μπορούν να δώσουν μόνο ένα πρωτόνιο. Παραδείγματα μονοπρωτικών οξέων περιλαμβάνουν:
- HCl (υδροχλωρικό οξύ)
- CH3 COOH (οξικό οξύ)
- HNO3 (νιτρικό οξύ)
Παρατηρήστε ότι το υδροχλωρικό οξύ και το νιτρικό οξύ έχουν και τα δύο μόνο ένα υδρογόνο στον τύπο τους και ότι το υδρογόνο είναι όξινο (που σημαίνει ότι μπορεί να απελευθερωθεί ως πρωτόνιο). Ωστόσο, το οξικό οξύ έχει υδρογόνα που ΔΕΝ είναι όξινα. Είναι σημαντικό να σημειωθεί ότι τα οξέα συχνά έχουν μη όξινα υδρογόνα.
Τι είναι τα πολυπρωτικά οξέα;
Πολυπρωτικό οξύ είναι οποιοδήποτε οξύ Bronsted-Lowry που μπορεί να δώσει περισσότερα από ένα πρωτόνια. Ενώ τα παραπάνω παραδείγματα μπορούν να απελευθερώσουν μόνο ένα πρωτόνιο, πολλά οξέα έχουν πολλαπλά όξινα υδρογόνα. Ακολουθούν μερικά παραδείγματα:
- H2 SO4 (θειικό οξύ)
- H3 PO4 (φωσφορικό οξύ)
- C10 H16 N2 O8 (Αιθυλενοδιαμινοτετραοξικό οξύ, ή EDTA για συντομία)
Κάθε ένα από αυτά τα οξέα έχει περισσότερα από ένα όξινα πρωτόνια. Το θειικό οξύ έχει δύο, επομένως θα ονομαζόταν di πρωτικό οξύ. Το φωσφορικό οξύ έχει τρία, επομένως ονομάζεται tri πρωτικό οξύ. Το EDTA έχει τέσσερα όξινα πρωτόνια, που σημαίνει ότι τεχνικά θα ονομαζόταν τετραπρωτικό οξύ, αλλά στην πράξη οποιοδήποτε οξύ με περισσότερα από τρία πρωτόνια ονομάζεται απλώς πολυπρωτικό. Θεωρητικά, δεν υπάρχει όριο στον αριθμό των όξινων πρωτονίων που θα μπορούσε να έχει ένα πολυπρωτικό οξύ.
Πώς λειτουργούν τα πολυπρωτικά οξέα;
Θυμηθείτε ότι όταν ένα οξύ εγκαταλείπει ένα πρωτόνιο, σχηματίζει αυτό που ονομάζεται συζευγμένη βάση. Για τα μονοπρωτικά οξέα, η συζευγμένη βάση δεν έχει όξινα πρωτόνια και μπορεί να λειτουργήσει (δεν αποτελεί έκπληξη) μόνο ως βάση. Ωστόσο, για τα πολυπρωτικά οξέα, η συζευγμένη βάση του αρχικού οξέος έχει όξινα πρωτόνια – με άλλα λόγια, η συζευγμένη βάση είναι επίσης οξύ . Ας δούμε μερικά παραδείγματα.
HCl ⇌ Cl + H
Στην παραπάνω ισορροπία, το υδροχλωρικό οξύ, ένα ισχυρό μονοπρωτικό οξύ, εγκαταλείπει το όξινο υδρογόνο του. Αυτό σχηματίζει τη συζευγμένη βάση, το χλωρίδιο, συν ένα πρωτόνιο. Δεν υπάρχουν πλέον όξινα πρωτόνια, επομένως δεν υπάρχει περαιτέρω αντίδραση.
H3 PO4 ⇌ H2 PO4 + H
Η παραπάνω ισορροπία δείχνει την απώλεια του πρώτου όξινου πρωτονίου από το φωσφορικό οξύ. Σημειώστε ότι μετά την απώλεια αυτού του πρωτονίου, υπάρχουν ακόμα όξινα πρωτόνια στη συζευγμένη βάση . Αυτό σημαίνει ότι η συζυγής βάση μπορεί να λειτουργήσει ως οξύ σε μια άλλη ισορροπία:
H2 PO4 ⇌ HPO4 + H
Και για άλλη μια φορά, υπάρχει ακόμα ένα όξινο πρωτόνιο στη (δεύτερη) συζευγμένη βάση. Επομένως, υπάρχει μια τελευταία αποπρωτονίωση που θα μπορούσε να συμβεί:
HPO4 ⇌ PO4 + H
Υπήρξαν τρεις αποπρωτονιώσεις που μόλις συνέβησαν, επειδή το αρχικό μόριο, το φωσφορικό οξύ, είναι τριπρωτικό.
Σε ένα τριπρωτικό οξύ, το οποίο Ka έχει την υψηλότερη τιμή;
Η οξύτητα των πολυπρωτικών οξέων είναι απλή:κάθε πρωτόνιο είναι λιγότερο όξινο από το προηγούμενο . Αυτό μπορεί να αναπαρασταθεί αριθμητικά με το Ka ή pKa τιμές για κάθε επόμενο είδος. Θυμηθείτε ότι Ka είναι η σταθερά ισορροπίας για μια αντίδραση οξέος-βάσης:όσο μεγαλύτερη είναι, τόσο ισχυρότερο είναι το οξύ.
H3 PO4 ⇌ H2 PO4 + H Ka1 =6,9 x 10
H2 PO4 ⇌ HPO4 + H Ka2 =6,2 x 10
HPO4 ⇌ PO4 + H Ka3 =4,8 x 10
Μεταξύ της πρώτης και της δεύτερης αποπρωτονίωσης, το Ka πέφτει κατά σχεδόν 5 τάξεις μεγέθους! Αυτό σημαίνει ότι το πρώτο πρωτόνιο ήταν 100.000 φορές πιο όξινο από το δεύτερο. Μεταξύ της δεύτερης και της τρίτης αποπρωτονίωσης, το Ka μειώθηκε κατά ΠΕΡΙΣΣΟΤΕΡΕΣ από 5 τάξεις μεγέθους. Αυτό σημαίνει ότι το πρώτο πρωτόνιο του φωσφορικού οξέος είναι περίπου 10 δισεκατομμύρια φορές πιο όξινο από το τρίτο του. Είναι γενικά κάπως δύσκολο να αφαιρέσετε το τελευταίο πρωτόνιο από ένα διπρωτικό ή τριπρωτικό οξύ.
Αυτός ο πίνακας δείχνει μια ποικιλία οξέων, συμπεριλαμβανομένων πολλών πολυπρωτικών. Μη διστάσετε να σαρώσετε και να παρατηρήσετε ότι κάθε πολυπρωτικό οξύ έχει μεγαλύτερο Ka1 από το Ka2 , το οποίο είναι μεγαλύτερο από το Ka3 , κ.λπ. Εάν επιλέξετε να χρησιμοποιήσετε το pKa Αντίθετα, να θυμάστε ότι το υψηλότερο pKa Η τιμή αντιπροσωπεύει χαμηλότερη οξύτητα, το αντίθετο του Ka .
Είναι τα διπρωτικά οξέα ισχυρότερα από τα μονοπρωτικά οξέα;
Οχι απαραίτητα. Ο αριθμός των όξινων υδρογόνων σε ένα μόριο δεν έχει καμία σχέση με το πόσο όξινα είναι αυτά τα υδρογόνα (ή συγκεκριμένα, πόσο όξινο είναι το ΠΙΟ όξινο). Το υδροχλωρικό οξύ (μονοπρωτικό) είναι πολύ ισχυρότερο από το φωσφορικό οξύ (τριπρωτικό), και το θειικό οξύ (διπρωτικό) είναι πολύ ισχυρότερο από το υδροφθορικό οξύ (μονοπρωτικό). Βασικά, ο αριθμός των υδρογόνων δεν κάνει διαφορά.
Καμπύλη τιτλοδότησης πολυπρωτικού οξέος
Μάθαμε πριν ότι όταν ένα πολυπρωτικό οξύ χάνει το πρώτο του πρωτόνιο, σχηματίζει ένα νέο ασθενές οξύ. Αυτό είναι σημαντικό να θυμάστε όταν εκτελείτε μια τιτλοδότηση, αναμφισβήτητα την πιο κοινή και σημαντική τεχνική στη χημεία οξέος/βάσης. Επειδή το νεοσχηματισμένο οξύ (η συζευγμένη βάση του αρχικού οξέος) μπορεί να χάσει τα πρωτόνια του, οι καμπύλες τιτλοδότησης για τα πολυπρωτικά οξέα μοιάζουν με πολλές «κανονικές» (μονοπρωτικές) καμπύλες τιτλοδότησης συνδεδεμένες μεταξύ τους, μία για κάθε όξινο πρωτόνιο. Εξετάστε την παρακάτω καμπύλη, η οποία αντιπροσωπεύει ένα διπρωτικό οξύ (όπως το θειικό οξύ) που τιτλοδοτείται με μια ισχυρή βάση.
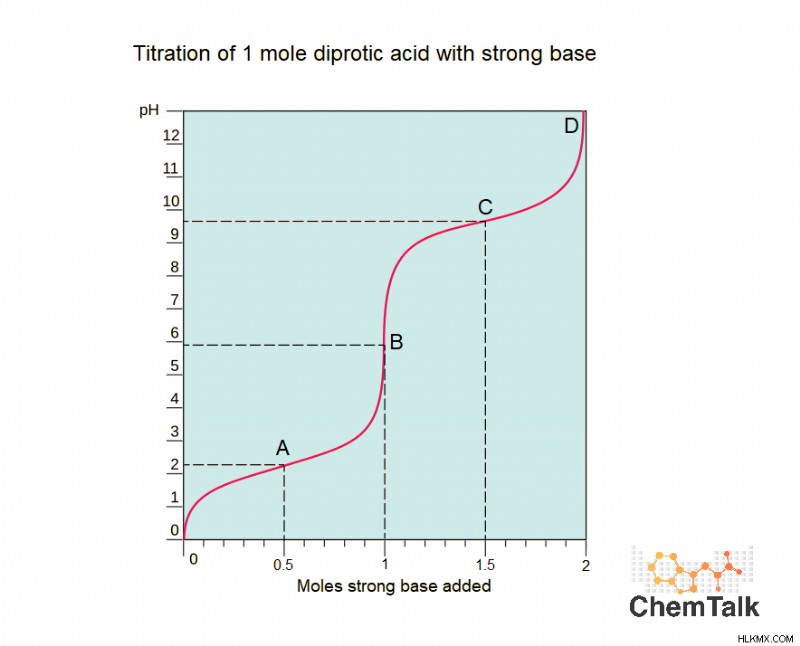
Υπάρχουν τέσσερα χαρακτηριστικά σημεία σε αυτή την καμπύλη, με την ένδειξη A, B, C και D.
Σημείο A
Στο σημείο Α, έχουν προστεθεί 0,5 mole βάσης, που σημαίνει ότι το μισό διπρωτικό οξύ έχει αποπρωτονιωθεί. Σημαίνει αυτό ότι το μισό οξύ δεν έχει πρωτόνια; ΟΧΙ! Σημαίνει ότι το ήμισυ του οξέος έχει χάσει ένα πρωτόνιο και έχει ακόμα ένα. Το άλλο μισό έχει και τα δύο πρωτόνια του. Σε αυτό το σημείο, η λύση είναι ένα ρυθμιστικό διάλυμα. Δείτε το συνδεδεμένο άρθρο για να μάθετε τι είναι η λύση buffer. Το διάλυμα είναι ρυθμιστικό επειδή το ήμισυ του αρχικού οξέος έχει μετατραπεί στη συζυγή του βάση. Το σημείο Α μπορεί να ονομαστεί περιοχή προσωρινής αποθήκευσης, συγκεκριμένα η πρώτη περιοχή προσωρινής αποθήκευσης, καθώς θα υπάρχει και δεύτερη.
Σημείο Β
Στο σημείο Β έχει προστεθεί 1 mole ισχυρής βάσης. Θυμηθείτε ότι το πρώτο πρωτόνιο είναι πάντα πιο όξινο από το δεύτερο. Αυτό σημαίνει ότι ΟΛΟ το αρχικό οξύ έχει χάσει το πρώτο του πρωτόνιο και ΜΟΝΟ το πρώτο του πρωτόνιο. Το σημείο Β θεωρείται σημείο ισοδυναμίας. Σε αντίθεση με μια κανονική τιτλοδότηση, με μόνο ένα σημείο ισοδυναμίας, οι τιτλοδοτήσεις των πολυπρωτικών οξέων θα έχουν πολλές, καθεμία που αντιστοιχεί στην πλήρη απώλεια κάθε διαδοχικού όξινου πρωτονίου.
Σημείο Γ
Σε αυτό το σημείο, ο μισός αναλυτής έχει χάσει και τα δύο πρωτόνια του και ο μισός έχει ακόμα ένα. Επειδή είναι ένα μείγμα 50/50 οξέος και συζυγούς βάσης, θεωρείται ρυθμιστικό.
Σημείο Δ
Το σημείο Δ είναι το δεύτερο (και τελευταίο) σημείο ισοδυναμίας. Στο σημείο D, όλο το αρχικό οξύ έχει αποπρωτονιωθεί πλήρως και έχει μετατραπεί σε βάση.
Περαιτέρω ανάγνωση
- Τι είναι το pKa
- Ισορροπία
- Τι είναι το Buffer Solution
- Χρήση τραπεζιού ICE