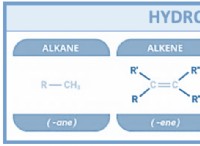
Όσο ελαφρύτερο το Atom Less Mass σε ένα mole αυτού του ατόμου;
* Ατομική μάζα: Η μάζα ενός ατόμου καθορίζεται κυρίως από τον αριθμό των πρωτονίων και των νετρονίων στον πυρήνα του. Τα ελαφρύτερα άτομα έχουν λιγότερα πρωτόνια και νετρόνια.
* mole: Ένα mole είναι ένας συγκεκριμένος αριθμός σωματιδίων (6.022 x 10^23). Ένα mole οποιουδήποτε στοιχείου περιέχει τον ίδιο αριθμό ατόμων.
* μάζα ενός mole: Δεδομένου ότι ένα mole οποιουδήποτε στοιχείου περιέχει τον ίδιο αριθμό ατόμων, η μάζα ενός mole είναι άμεσα ανάλογη προς την ατομική μάζα του στοιχείου. Ως εκ τούτου, τα ελαφρύτερα άτομα με χαμηλότερες ατομικές μάζες θα έχουν χαμηλότερη μάζα ανά mole.
Παράδειγμα:
* Το υδρογόνο (Η) έχει ατομική μάζα περίπου 1 μονάδας ατομικής μάζας (AMU).
* Το οξυγόνο (Ο) έχει ατομική μάζα περίπου 16 AMU.
Αυτό σημαίνει ότι ένα mole του υδρογόνου θα έχει μάζα περίπου 1 γραμμάριο, ενώ ένα mole οξυγόνου θα έχει μάζα περίπου 16 γραμμάρια.