Γιατί το άζωτο έχει χρέωση του αρνητικού 3 όταν συμμετέχει σε χημική αντίδραση;
* Ηλεκτρονική διαμόρφωση: Το άζωτο έχει 5 ηλεκτρόνια σθένους (ηλεκτρόνια στο εξώτατο κέλυφος). Για να επιτευχθεί ένα σταθερό οκτάδα (8 ηλεκτρόνια), πρέπει να κερδίσει 3 ακόμη ηλεκτρόνια. Αυτό το κέρδος των ηλεκτρονίων του δίνει αρνητική φόρτιση.
* Ηλεκτροργατιστικότητα: Το άζωτο είναι ένα εξαιρετικά ηλεκτροαρνητικό στοιχείο, που σημαίνει ότι προσελκύει έντονα ηλεκτρόνια. Σε ομοιοπολικούς δεσμούς, το άζωτο συχνά τραβά τα ηλεκτρόνια προς τον εαυτό του, δίνοντάς του ένα μερικό αρνητικό φορτίο.
* Ιωνικές ενώσεις: Σε ορισμένες ιοντικές ενώσεις, το άζωτο σχηματίζει ανιόντα με -3 φορτίο (όπως στα νιτρίδια, π.χ. Mg₃n₂).
Ωστόσο, είναι σημαντικό να σημειώσετε:
* καταστάσεις οξείδωσης: Το άζωτο μπορεί να παρουσιάζει διάφορες καταστάσεις οξείδωσης (από -3 έως +5) ανάλογα με το περιβάλλον συγκόλλησης.
* ομοιοπολικοί δεσμοί: Σε ομοιοπολικούς δεσμούς, το φορτίο για το άζωτο δεν είναι πλήρης -3, αλλά μάλλον ένα μερικό αρνητικό φορτίο λόγω της διαφοράς ηλεκτροαρνητικότητας.
Παραδείγματα:
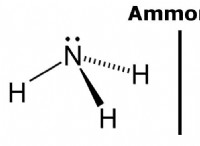
* αμμωνία (NH₃): Το άζωτο έχει επίσημο φορτίο -3 στην αμμωνία επειδή μοιράζεται 3 ηλεκτρόνια με τα 3 άτομα υδρογόνου.
* Νιτρικό οξύ (HNO₃): Το άζωτο έχει κατάσταση οξείδωσης +5 σε νιτρικό οξύ, καθώς έχει χάσει 5 ηλεκτρόνια.
* Αέριο αζώτου (n₂): Στη στοιχειακή μορφή, το άζωτο έχει κατάσταση οξείδωσης 0, καθώς μοιράζεται ηλεκτρόνια εξίσου με ένα άλλο άτομο αζώτου.
Συμπερασματικά: Ενώ το άζωτο * μπορεί * να έχει φορτίο -3 σε ορισμένες χημικές αντιδράσεις, δεν είναι καθολικός κανόνας. Το φορτίο του αζώτου εξαρτάται από το συγκεκριμένο χημικό περιβάλλον και τους συνεργάτες συγκόλλησης.