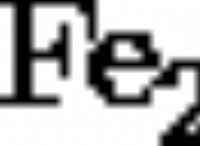Γιατί το στοιχειώδες νάτριο αντιδρά και χλώριο τόσο εύκολα;
* νάτριο (na) Έχει ένα μόνο ηλεκτρόνιο σθένους, που σημαίνει ότι χρειάζεται μόνο να χάσει ένα ηλεκτρόνιο για να επιτύχει ένα σταθερό, πλήρες εξωτερικό κέλυφος όπως τα ευγενή αέρια.
* χλώριο (cl) έχει επτά ηλεκτρόνια σθένους και πρέπει να κερδίσει ένα ηλεκτρόνιο για να επιτύχει ένα σταθερό, πλήρες εξωτερικό κέλυφος.
Εδώ συμβαίνει η αντίδραση:
1. Το νάτριο χάνει εύκολα το ηλεκτρόνιο σθένος , να γίνει θετικά φορτισμένο ιόν νατρίου (Na+). Αυτό οφείλεται στο γεγονός ότι απαιτεί λιγότερη ενέργεια για να χάσει ένα ηλεκτρόνιο παρά να κερδίσει επτά.
2. Το χλώριο κερδίζει εύκολα ένα ηλεκτρόνιο , να γίνει ένα αρνητικά φορτισμένο χλωριούχο ιόν (cl-). Αυτό οφείλεται στο γεγονός ότι είναι ενεργά ευνοϊκό να γεμίσει το εξωτερικό του κέλυφος.
3. Τα αντίθετα φορτισμένα ιόντα προσελκύονται έντονα μεταξύ τους Λόγω των ηλεκτροστατικών δυνάμεων, σχηματίζοντας ένα ιοντικό δεσμό. Αυτός ο δεσμός δημιουργεί μια σταθερή ένωση, χλωριούχο νάτριο (NaCl), γνωστό και ως επιτραπέζιο αλάτι.
Βασικά σημεία:
* Ενέργεια χαμηλής ιονισμού του νατρίου: Το νάτριο χάνει εύκολα το ηλεκτρόνιο του λόγω της χαμηλής ενέργειας του ιονισμού.
* Υψηλή συγγένεια ηλεκτρονίων του χλωρίου: Το χλώριο κερδίζει εύκολα ένα ηλεκτρόνιο λόγω της υψηλής συγγένειας ηλεκτρονίων του.
* Ισχυρό ιοντικό δεσμό: Ο προκύπτων ιοντικός δεσμός μεταξύ νατρίου και χλωρίου είναι πολύ ισχυρός, συμβάλλοντας στην υψηλή αντιδραστικότητα της αντίδρασης.
Αυτός ο συνδυασμός παραγόντων καθιστά την αντίδραση μεταξύ νατρίου και χλωρίου ιδιαίτερα εξωθερμικής (ενέργεια απελευθέρωσης), οδηγώντας σε μια έντονη και συχνά εκρηκτική αντίδραση.