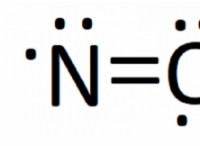Οι ιοντικοί δεσμοί είναι αρκετά ισχυροί για να προκαλέσουν όλες τις ιοντικές ενώσεις;
Εδώ είναι γιατί:
* Ισχυρή ηλεκτροστατική έλξη: Οι ιοντικοί δεσμοί περιλαμβάνουν τη μεταφορά ηλεκτρονίων, δημιουργώντας θετικά και αρνητικά φορτισμένα ιόντα. Αυτές οι αντίθετες χρεώσεις προσελκύουν ο ένας τον άλλον έντονα, σχηματίζοντας μια άκαμπτη δομή πλέγματος.
* υψηλά σημεία τήξης και βρασμού: Οι ισχυρές ηλεκτροστατικές δυνάμεις απαιτούν μια σημαντική ποσότητα ενέργειας για να ξεπεραστεί, οδηγώντας σε υψηλά σημεία τήξης και βρασμού για τις περισσότερες ιοντικές ενώσεις.
* Βρετανία: Όταν το στρες εφαρμόζεται σε ένα ιοντικό κρύσταλλο, τα ιόντα μπορούν να μετατοπιστούν από την ευθυγράμμιση, να διαταράσσουν την ηλεκτροστατική ισορροπία και να οδηγούν στο θραύσμα των κρυστάλλων.
Ωστόσο, είναι σημαντικό να σημειωθεί ότι υπάρχουν εξαιρέσεις:
* Ορισμένες ιοντικές ενώσεις μπορούν να είναι υγρά σε θερμοκρασία δωματίου: Για παράδειγμα, λιωμένα άλατα όπως το χλωριούχο νάτριο (NaCl) λιώνουν σε υψηλές θερμοκρασίες, γίνονται υγρά.
* Ιωνικές ενώσεις μπορούν να σχηματίσουν σύνθετες δομές: Δεν υπάρχουν όλες οι ιοντικές ενώσεις ως απλά, άκαμπτα πλέγματα. Ορισμένες σχηματίζουν σύνθετες δομές με ποικίλα επίπεδα αντοχής συγκόλλησης.
Συνολικά, η αντοχή των ιοντικών δεσμών είναι ένας σημαντικός παράγοντας για τον προσδιορισμό των φυσικών ιδιοτήτων των ιοντικών ενώσεων, που συχνά οδηγούν σε στερεά, εύθραυστα υλικά με υψηλά σημεία τήξης.