Νέον Γεγονότα
Το νέον είναι το δέκατο στοιχείο του περιοδικού πίνακα. Αυτά τα νέα στοιχεία περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Βασικά στοιχεία νέον
Όνομα: Νέον
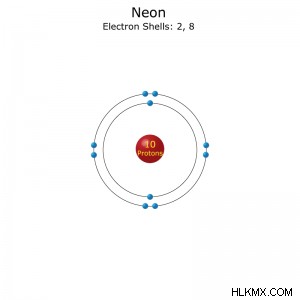
Ατομικός αριθμός: 10
Σύμβολο στοιχείου: Ne
Ομάδα: 18
Περίοδος: 2
Αποκλεισμός: p
Οικογένεια στοιχείων: ευγενές αέριο
Ατομική μάζα: 20.1797(6)
Διαμόρφωση ηλεκτρονίου: [He]2s2p(συντομογραφία) ή 1s2s2p(πλήρη)
Ανακάλυψη: Ο Sir William Ramsay και ο Morris W. Travers το 1898.
Ο Ramsay είχε ήδη ανακαλύψει αργό και ήλιο. Συμπέρασε ότι πρέπει να υπάρχει ένα στοιχείο στον περιοδικό πίνακα που θα εμφανιζόταν μεταξύ των δύο. Τελικά διαχώρισαν τα αέρια από τον υγρό αέρα υπό μειωμένη πίεση. Ιονίσανε τα δείγματά τους για να λάβουν τα φάσματα τους. Ένα δείγμα έλαμψε με ένα ζωηρό κόκκινο φως που δεν είχε ξαναδεί. Ήξεραν αμέσως ότι είχαν ανακαλύψει το στοιχείο νέον.
Προέλευση ονόματος: Ο Ramsay ονόμασε το στοιχείο νέο από την ελληνική λέξη neos σημαίνει νέο.
Ισότοπα:
Το φυσικό νέο αποτελείται από τρία σταθερά ισότοπα:Ne, Ne και Ne. Δεκαέξι Ραδιενεργά ισότοπα έχουν παραχθεί σε εργαστηριακές συνθήκες που κυμαίνονται από Ne έως Ne.
Ne
Το Neon-20 είναι ένα σταθερό ισότοπο που περιέχει 10 νετρόνια. Το 90,48% του φυσικού νέον είναι νέον-20.
Ne
Το Neon-21 είναι ένα σταθερό ισότοπο που περιέχει 11 νετρόνια. Το 0,27% του φυσικού νέον είναι νέον-21.
Ne
Το Neon-22 είναι ένα σταθερό ισότοπο που περιέχει 12 νετρόνια. Το 9,25% του φυσικού νέον είναι νέον-22.

Φυσικά δεδομένα
Πυκνότητα: 0,000825 g/cm
Σημείο τήξης: 24,56 K (−248,59 °C, −415,46 °F
Σημείο βρασμού: 27,104 K (−246,046 °C, −410,883 °F)
Τριπλό σημείο: 24,5561 K σε 43,37 kPa
Κρίσιμο σημείο: 44,4918 K, 2,7686 MPa
Κατάσταση στους 20ºC: Αέριο
Heat of Fusion: 0,335 kJ/mol
Θερμότητα εξάτμισης: 1,71 kJ/mol
Μοριακή θερμική χωρητικότητα: 20,79 J/mol·K
Ατομικά δεδομένα
Ατομική ακτίνα: 1,54 Å
Ομοιοπολική ακτίνα: 0,58 Å
Ακτίνα Van der Waals: 1,54 Å
Συγγένεια ηλεκτρονίων: μη σταθερό
Ηλεκτραρνητικότητα: άγνωστο
1 Ενέργεια Ιονισμού: 2080,662 kJ/mol
2 Ενέργεια Ιονισμού: 3952,325 kJ/mol
3 Ενέργεια Ιονισμού: 6121,99 kJ/mol
4 Ενέργεια Ιονισμού: 9370,66 kJ/mol
5 Ενέργεια Ιονισμού: 12177,41 kJ/mol
6 Ενέργεια Ιονισμού: 15237,93 kJ/mol
7 Ενέργεια Ιονισμού: 19999,086 kJ/mol
8 Ενέργεια Ιονισμού: 23069,539 kJ/mol
Καταστάσεις οξείδωσης: 0

Διασκεδαστικά νέα στοιχεία
- Το νέον είναι ένα άχρωμο, άοσμο και άγευστο αέριο σε θερμοκρασία δωματίου.
- Το νέον είναι το τέταρτο πιο άφθονο στοιχείο στο σύμπαν, αλλά είναι σχετικά σπάνιο στη Γη. Μόνο ένα μέρος σε 55.000 μέρη αέρα είναι νέον.
- Το νέον δεν συνδέεται φυσικά με άλλα στοιχεία. Δεν υπάρχουν γνωστές ενώσεις ηλίου.
- Η διάσημη ταμπέλα νέον εφευρέθηκε το 1910 από τον Georges Claude. Έκαναν το ντεμπούτο τους στην έκθεση Paris Expo.
- Το νέο είναι μονατομικό και είναι ελαφρύτερο από τα διατομικά στοιχεία του αζώτου και του οξυγόνου στον αέρα. Εάν γεμίσετε ένα μπαλόνι με αέριο νέον, θα επιπλέει σαν ένα μπαλόνι γεμάτο ήλιο, αλλά θα ανεβαίνει πιο αργά.
- Το νέον χρησιμοποιείται σε αντικεραυνικά σε καλώδια ηλεκτρικού ρεύματος και τηλεφωνικούς πόλους.
- Η μόνη εμπορική πηγή νέον είναι ο αέρας.
- Το υγρό νέον χρησιμοποιείται ως ψυκτικό μέσο. Έχει σαράντα φορές μεγαλύτερη ικανότητα ψύξης ανά όγκο υγρού ηλίου και τριπλάσια από το υγρό υδρογόνο.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




