Πώς η χημική μεταφορά ενέργειας στην ηλεκτρική ενέργεια;
1. Χημικές αντιδράσεις:
* μπαταρίες: Οι χημικές αντιδράσεις εμφανίζονται μέσα σε μια μπαταρία, η οποία περιλαμβάνει ροή ηλεκτρονίων μεταξύ δύο διαφορετικών υλικών (ηλεκτρόδια) που βυθίζονται σε διάλυμα ηλεκτρολύτη. Αυτές οι αντιδράσεις απελευθερώνουν χημική ενέργεια, οδηγώντας τα ηλεκτρόνια να μετακινούνται από το ένα ηλεκτρόδιο στο άλλο, δημιουργώντας μια διαφορά ηλεκτρικού δυναμικού (τάση).
* Κύτταρα καυσίμου: Τα κύτταρα καυσίμου χρησιμοποιούν χημικές αντιδράσεις μεταξύ ενός καυσίμου (όπως το υδρογόνο) και ενός οξειδωτικού (όπως το οξυγόνο) για την παραγωγή ηλεκτρικής ενέργειας. Το καύσιμο οξειδώνεται, απελευθερώνοντας ηλεκτρόνια που ταξιδεύουν μέσω ενός εξωτερικού κυκλώματος, δημιουργώντας ένα ηλεκτρικό ρεύμα.
2. Ροή ηλεκτρονίων:
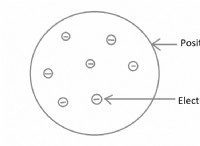
* Οι χημικές αντιδράσεις δημιουργούν μια διαφορά δυναμικού μεταξύ των ηλεκτροδίων, προκαλώντας ρέοντα ηλεκτρόνια από το αρνητικό ηλεκτρόδιο (άνοδο) στο θετικό ηλεκτρόδιο (κάθοδος) μέσω ενός εξωτερικού κυκλώματος. Αυτή η ροή ηλεκτρονίων αποτελεί ηλεκτρικό ρεύμα.
* Το μέγεθος του ηλεκτρικού ρεύματος εξαρτάται από τον ρυθμό της χημικής αντίδρασης και την αντίσταση του κυκλώματος.
3. Μετατροπή ενέργειας:
* Η χημική ενέργεια που αποθηκεύεται μέσα στα αντιδραστήρια (μόρια) μετατρέπεται σε κινητική ενέργεια των ηλεκτρονίων, η οποία στη συνέχεια αξιοποιείται ως ηλεκτρική ενέργεια.
* Η αποτελεσματικότητα αυτής της μετατροπής ποικίλλει ανάλογα με τις συγκεκριμένες χημικές αντιδράσεις και την εμπλεκόμενη τεχνολογία.
Παραδείγματα:
* μπαταρία: Μια απλή μπαταρία χρησιμοποιεί μια άνοδο ψευδαργύρου και μια κάθοδο χαλκού σε ένα διάλυμα ηλεκτρολύτη. Το ψευδάργυρο απελευθερώνει ηλεκτρόνια για να γίνουν ιόντα ψευδαργύρου, ενώ τα ιόντα χαλκού στα ηλεκτρόνια κερδίζουν τα ηλεκτρόνια για να γίνουν άτομα χαλκού. Αυτή η ροή ηλεκτρονίων παράγει ένα ρεύμα που μπορεί να τροφοδοτήσει μια συσκευή.
* Κύτήρια καυσίμου: Μια κυψέλη καυσίμου υδρογόνου χρησιμοποιεί μια αντίδραση μεταξύ υδρογόνου και οξυγόνου για την παραγωγή ηλεκτρικής ενέργειας. Το υδρογόνο οξειδώνεται για να σχηματίσει νερό, απελευθερώνοντας ηλεκτρόνια που ρέουν μέσω ενός εξωτερικού κυκλώματος για να παράγουν ηλεκτρική ενέργεια.
Βασικά σημεία:
* Αντιδράσεις οξειδοαναγωγής: Οι χημικές αντιδράσεις που εμπλέκονται στη μεταφορά της χημικής ενέργειας στην ηλεκτρική ενέργεια είναι συνήθως αντιδράσεις οξειδοαναγωγής, όπου ένα χημικό είδος οξειδώνεται (χάνει ηλεκτρόνια) και ένα άλλο μειώνεται (κερδίζει ηλεκτρόνια).
* ηλεκτροχημικά κύτταρα: Οι συσκευές που διευκολύνουν αυτή τη μεταφορά ονομάζονται ηλεκτροχημικά κύτταρα. Αποτελούνται από ηλεκτρόδια, ηλεκτρολύτη και εξωτερικό κύκλωμα.
* Διατήρηση ενέργειας: Η ενέργεια που απελευθερώνεται στις χημικές αντιδράσεις διατηρείται, με κάποια απώλεια ως θερμότητα λόγω αναποτελεσματικότητας.
Με την κατανόηση της διαδικασίας της μεταφοράς χημικής ενέργειας στην ηλεκτρική ενέργεια, μπορούμε να κατανοήσουμε καλύτερα και να σχεδιάσουμε διάφορες τεχνολογίες που χρησιμοποιούν αυτή τη θεμελιώδη αρχή, από τις καθημερινές μπαταρίες μέχρι τα ισχυρά κύτταρα καυσίμου.