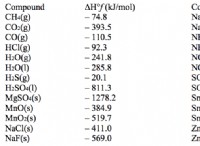
Ποια στοιχεία έχουν σχετικά μικρή ενέργεια πυρηνικής δέσμευσης ανά σωματίδιο;
* Ενέργεια πυρηνικής δέσμευσης: Αυτή είναι η ενέργεια που απαιτείται για να σπάσει τον πυρήνα ενός ατόμου στα μεμονωμένα πρωτόνια και τα νετρόνια. Μια υψηλότερη ενέργεια δέσμευσης υποδεικνύει έναν πιο σταθερό πυρήνα.
* Ενέργεια δέσμευσης ανά σωματίδιο: Αυτή είναι η ενέργεια δέσμευσης διαιρούμενο με τον αριθμό των νουκλεονίων (πρωτόνια και νετρόνια) στον πυρήνα. Δίνει ένα μέτρο για το πόσο έντονα κάθε πυρήνας δεσμεύεται μέσα στον πυρήνα.
Γιατί τα ελαφρύτερα στοιχεία έχουν χαμηλότερη ενέργεια δέσμευσης ανά σωματίδιο:
* Ισχυρή πυρηνική δύναμη: Αυτή η δύναμη συγκρατεί πρωτόνια και νετρόνια στον πυρήνα. Είναι πολύ ισχυρό σε μικρές αποστάσεις, αλλά αποδυναμώνει γρήγορα καθώς η απόσταση μεταξύ των νουκλεονίων αυξάνεται.
* Ηλεκτροστατική απόρριψη: Τα πρωτόνια, που είναι θετικά χρεώνονται, απωθούν ο ένας τον άλλον. Αυτή η δύναμη αυξάνεται καθώς αυξάνεται ο αριθμός των πρωτονίων στον πυρήνα.
* ισορροπία: Σε ελαφρύτερους πυρήνες, η ισχυρή πυρηνική δύναμη είναι πιο κυρίαρχη, αλλά καθώς ο πυρήνας μεγαλώνει, η ηλεκτροστατική απόρριψη γίνεται όλο και πιο σημαντική. Αυτό οδηγεί σε μείωση της ενέργειας δέσμευσης ανά σωματίδιο.
Παραδείγματα:
* υδρογόνο: Ο πυρήνας του αποτελείται από ένα μόνο πρωτόνιο, οπότε η ενέργεια δέσμευσης ανά σωματίδιο είναι ουσιαστικά μηδενική.
* ήλιο: Έχει σχετικά υψηλή ενέργεια δέσμευσης ανά σωματίδιο σε σύγκριση με το υδρογόνο, αλλά εξακολουθεί να είναι χαμηλότερη από τα βαρύτερα στοιχεία.
Σημαντική σημείωση: Η ενέργεια δέσμευσης ανά σωματίδιο φτάνει στην κορυφή γύρω από το σίδηρο (Fe) . Τα στοιχεία βαρύτερα από τον σίδηρο έχουν χαμηλότερη ενέργεια δέσμευσης ανά σωματίδιο, που σημαίνει ότι είναι λιγότερο σταθερά και μπορούν να απελευθερώσουν ενέργεια μέσω της πυρηνικής σχάσης.