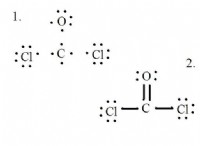Πώς ξέρετε ποια ένωση πρέπει να έχει ιοντική δομή;
Κατανόηση της ιοντικής σύνδεσης
* Ηλεκτροστατική έλξη: Οι ιοντικοί δεσμοί σχηματίζονται όταν ένα άτομο μετάλλου (το οποίο τείνει να χάσει ηλεκτρόνια) μεταφέρει ηλεκτρόνια σε μη μέταλλο άτομο (που τείνει να κερδίζει ηλεκτρόνια). Αυτό δημιουργεί αντίθετα φορτισμένα ιόντα που προσελκύονται έντονα ο ένας στον άλλο.
* Διαφορά ηλεκτροαρνητικότητας: Ο βασικός παράγοντας για τον προσδιορισμό εάν ένας δεσμός θα είναι ιοντικός είναι η διαφορά στην ηλεκτροαρνητικότητα μεταξύ των δύο ατόμων που εμπλέκονται. Η ηλεκτροαρνητικότητα είναι ένα μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια.
* Μεγάλη διαφορά: Μια μεγάλη διαφορά ηλεκτροαρνητικότητας (γενικά μεγαλύτερη από 1,7) δείχνει ότι ένα άτομο θα τραβήξει τα ηλεκτρόνια μακριά από το άλλο άτομο, με αποτέλεσμα έναν ιοντικό δεσμό.
* Μικρή διαφορά: Μια μικρή διαφορά ηλεκτροαρνητικότητας υποδεικνύει έναν πιο ομοιοπολικό δεσμό (κοινή χρήση ηλεκτρονίων).
Πώς να προβλέψετε ιοντική δομή
1. Προσδιορίστε τα στοιχεία: Προσδιορίστε τα στοιχεία που εμπλέκονται στην ένωση.
2. Αναζητήστε μέταλλα και μη μέταλλα:
* Οι ιοντικές ενώσεις συνήθως περιλαμβάνουν ένα μέταλλο και ένα μέταλλο.
* Για παράδειγμα:NaCl (χλωριούχο νάτριο), MGO (οξείδιο μαγνησίου)
3. Εξετάστε την ηλεκτροαρνητικότητα: Χρησιμοποιήστε έναν περιοδικό πίνακα πίνακα ή ηλεκτροαρνητικότητα για να συγκρίνετε τις τιμές ηλεκτροαρνητικότητας των στοιχείων. Μια μεγάλη διαφορά υποδηλώνει έναν ιοντικό δεσμό.
4. Αναγνωρίστε κοινές ιοντικές ομάδες:
* Πολυατομικά ιόντα: Ορισμένες ομάδες ατόμων δρουν ως ενιαία μονάδα με φορτίο (π.χ. θειικό άλας (So₄2⁻), νιτρικά (NO₃⁻), αμμωνίου (NH₄⁺)). Αυτές οι ομάδες συχνά συμμετέχουν σε ιοντική συγκόλληση.
Παραδείγματα:
* NaCl (χλωριούχο νάτριο): Το νάτριο (Na) είναι ένα μέταλλο και το χλώριο (CL) είναι μη μέταλλο. Η διαφορά ηλεκτροαρνητικότητας είναι μεγάλη. Έτσι, το NaCl είναι ιοντικό.
* Co₂ (διοξείδιο του άνθρακα): Ο άνθρακας (C) και το οξυγόνο (O) είναι και τα δύο μη μέταλλα. Η διαφορά ηλεκτροαρνητικότητας είναι σχετικά μικρή, οδηγώντας σε ομοιοπολικό δεσμό.
* caco₃ (ανθρακικό ασβέστιο): Το ασβέστιο (Ca) είναι ένα μέταλλο και η ανθρακική ομάδα (Co₃2⁻) δρα ως πολυατομικό ιόν. Αυτή είναι μια ιοντική ένωση.
Πρόσθετες εκτιμήσεις:
* Εξαιρέσεις: Υπάρχουν μερικές εξαιρέσεις από τους γενικούς κανόνες. Ορισμένες ενώσεις που περιέχουν μέταλλα μπορούν να σχηματίσουν ομοιοπολικούς δεσμούς και ορισμένες ενώσεις που περιέχουν μη μέταλλα μπορούν να σχηματίσουν ιοντικούς δεσμούς.
* Πολυατομικά ιόντα: Εάν μια ένωση περιέχει ένα πολυατομικό ιόν, είναι πιθανό ιοντικό, ακόμη και αν η συνολική ένωση περιέχει μόνο μη μέταλλα.
Επιτρέψτε μου να ξέρω αν θέλετε περισσότερα παραδείγματα ή θέλετε να εργαστείτε μέσω συγκεκριμένων ενώσεων!