Πώς να υπολογίσετε την επίσημη χρέωση του CoCl2
Κατά τον προσδιορισμό του τυπικού φορτίου ενός μορίου όπως το CoCl2 (αέριο φωσγένιο), πρέπει να γνωρίζετε τον αριθμό των ηλεκτρονίων σθένους για κάθε άτομο και τη δομή Lewis του μορίου.
Αριθμός ηλεκτρονίων σθένους
Αναζητήστε κάθε άτομο στον περιοδικό πίνακα στοιχείων για να προσδιορίσετε τον αριθμό των ηλεκτρονίων σθένους.
Θυμηθείτε ότι δύο ηλεκτρόνια πηγαίνουν στο πρώτο s φλοιό, δύο ηλεκτρόνια στο δεύτερο φλοιό s, έξι ηλεκτρόνια στο πρώτο φλοιό p, κ.λπ. Ως υπενθύμιση:1s(^2)2s(^2)2p(^6)3s( ^2)3p(^6)
Ρυθμίστε για χρέωση. Εάν το μόριο είναι ιόν, προσθέστε ή αφαιρέστε ένα ή περισσότερα ηλεκτρόνια συνολικά για να ληφθεί υπόψη το τελικό φορτίο.
Για CoCl2 (αέριο φωσγένιο):C =4; O =6; Cl =7. Το μόριο δεν είναι ιονισμένο και έχει ουδέτερο φορτίο. Επομένως, η συνολική ποσότητα ηλεκτρονίων σθένους είναι 4 + 6 + (7x2) =24.
Δομή Lewis
Δείτε το διάγραμμα για τη δομή Lewis του CoCl2 (αέριο φωσγένιο). Η δομή Lewis αντιπροσωπεύει την πιο σταθερή και πιθανή δομή για ένα μόριο. Τα άτομα σχεδιάζονται με ζευγαρωμένα ηλεκτρόνια σθένους. σχηματίζονται δεσμοί μεταξύ μεμονωμένων ηλεκτρονίων για να ικανοποιηθεί ο κανόνας της οκτάδας.
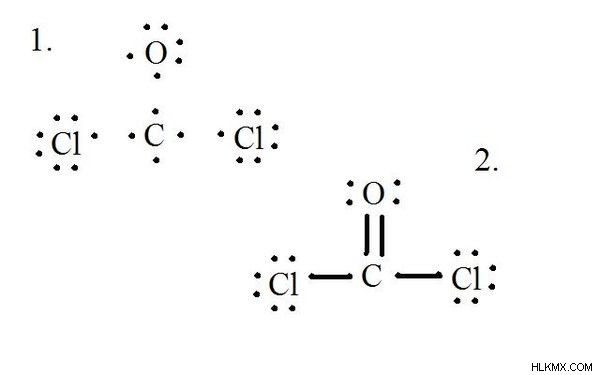
Σχεδιάστε κάθε άτομο και τα ηλεκτρόνια σθένους του και, στη συνέχεια, σχηματίστε δεσμούς όπως χρειάζεται.
Τα άτομα χλωρίου μοιράζονται απλούς δεσμούς με το μόριο άνθρακα, ενώ το άτομο οξυγόνου σχηματίζει διπλό δεσμό με τον άνθρακα. Κάθε άτομο στην τελική δομή ικανοποιεί τον κανόνα της οκτάδας και έχει οκτώ ηλεκτρόνια σθένους που επιτρέπουν τη μοριακή σταθερότητα.
Τυπική χρέωση κάθε ατόμου
-
Ο υπολογισμός του τυπικού φορτίου για μόρια που περιέχουν μέταλλα μετάπτωσης μπορεί να είναι δύσκολος. Ο αριθμός των ηλεκτρονίων σθένους για τα μέταλλα μετάπτωσης θα είναι εκείνος που βρίσκεται εκτός του πυρήνα που μοιάζει με ευγενή αέριο.
Μετρήστε τα μόνα ζεύγη κάθε ατόμου στη δομή Lewis. Εκχωρήστε σε κάθε άτομο ένα ηλεκτρόνιο από κάθε δεσμό στον οποίο συμμετέχει. Προσθέστε αυτούς τους αριθμούς μαζί. Σε CoCl2:C =0 μεμονωμένα ζεύγη συν 4 ηλεκτρόνια από δεσμούς =4 ηλεκτρόνια. Ο =4 ηλεκτρόνια από μεμονωμένα ζεύγη συν 2 ηλεκτρόνια από δεσμούς =6 ηλεκτρόνια. Cl =6 ηλεκτρόνια από μεμονωμένα ζεύγη συν 1 ηλεκτρόνιο από δεσμό με C =7 ηλεκτρόνια.
Αφαιρέστε το άθροισμα από τον αριθμό των ηλεκτρονίων σθένους στο μη δεσμευμένο άτομο. Το αποτέλεσμα είναι το επίσημο φορτίο για αυτό το άτομο. Σε CoCl2:C =4 ηλεκτρόνια σθένους (v.e.) σε μη δεσμευμένο άτομο μείον 4 εκχωρημένα ηλεκτρόνια στη δομή Lewis (L.s.) =0 τυπικό φορτίο O =6 v.e. - 6 Λ.σ. =0 επίσημη χρέωση Cl =7 v.e. - 7 Λ.σ. =0 επίσημη χρέωση
Γράψτε αυτά τα φορτία δίπλα στα άτομα στη δομή Lewis. Εάν το συνολικό μόριο έχει φορτίο, περικλείστε τη δομή Lewis σε αγκύλες με το φορτίο γραμμένο έξω από τις αγκύλες στην επάνω δεξιά γωνία.