Τι είδους στοιχείο σχηματίζει ανιόν μετά από ιοντική συγκόλληση;
* Ηλεκτροργατιστικότητα: Τα μη μέταλλα έχουν υψηλότερη ηλεκτροαρνητικότητα από τα μέταλλα. Αυτό σημαίνει ότι έχουν ισχυρότερη έλξη για τα ηλεκτρόνια.
* κέρδος ηλεκτρονίων: Όταν ένα μη μέταλλο ατόμων δεσμών με ένα άτομο μετάλλου, τείνει να κερδίσει ένα ή περισσότερα ηλεκτρόνια για να επιτύχει μια σταθερή διαμόρφωση ηλεκτρονίων (συνήθως ένα πλήρες εξωτερικό κέλυφος). Αυτό το κέρδος των ηλεκτρονίων οδηγεί σε αρνητικό φορτίο, σχηματίζοντας ένα ανιόν.
Παραδείγματα:
* οξυγόνο (o): Στις ιοντικές ενώσεις, το οξυγόνο κερδίζει συχνά δύο ηλεκτρόνια για να σχηματίσει το ιόν οξειδίου (O2⁻).
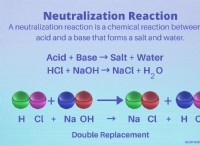
* χλώριο (CL): Το χλώριο κερδίζει ένα ηλεκτρόνιο για να γίνει το ιόν χλωριούχου (CL⁻).
* αζώτου (n): Το άζωτο μπορεί να κερδίσει τρία ηλεκτρόνια για να σχηματίσει το ιόν νιτριδίου (N³⁻).
Βασικό σημείο: Η ιοντική συγκόλληση περιλαμβάνει τη μεταφορά ηλεκτρονίων μεταξύ των ατόμων, οδηγώντας στο σχηματισμό αντίθετα φορτισμένων ιόντων (κατιόντα και ανιόντες). Τα μη μέταλλα είναι τα στοιχεία που συνήθως αποκτούν ηλεκτρόνια για να σχηματίσουν ανιόντα.