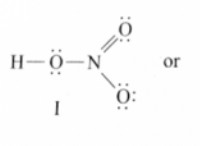
Ποιος είναι ο αριθμός οξείδωσης των μη μετάλλων;
* Τα μη μετάλλια είναι μια διαφορετική ομάδα: Περιλαμβάνουν στοιχεία όπως οξυγόνο, άζωτο, χλώριο, άνθρακα, θείο και πολλά άλλα.
* Οι αριθμοί οξείδωσης ποικίλλουν: Τα μη μέταλλα μπορούν να έχουν διαφορετικούς αριθμούς οξείδωσης ανάλογα με την ένωση που βρίσκονται. Αυτό οφείλεται στην ικανότητά τους να κερδίζουν ή να μοιράζονται ηλεκτρόνια με άλλα άτομα.
Εδώ είναι πώς να υπολογίσετε τον αριθμό οξείδωσης ενός μη μέταλλου σε μια συγκεκριμένη ένωση:
1. Απομνημονεύστε τους κοινούς αριθμούς οξείδωσης: Πολλά μη μέταλλα έχουν κοινές καταστάσεις οξείδωσης που πρέπει να γνωρίζετε. Για παράδειγμα:
* Οξυγόνο:Συνήθως -2 (εκτός από τα υπεροξείδια όπου είναι -1)
* Halogens (F, CL, BR, I):Συνήθως -1
* Υδρογόνο:συνήθως +1 (εκτός από μεταλλικά υδρίδια όπου είναι -1)
2. Εφαρμογή κανόνων:
* Το άθροισμα των αριθμών οξείδωσης σε μια ουδέτερη ένωση είναι 0.
* Το άθροισμα των αριθμών οξείδωσης σε ένα πολυατομικό ιόν ισούται με το φορτίο του ιόντος.
3. Συναναγία του αριθμού οξείδωσης:Χρησιμοποιήστε τους παραπάνω κανόνες και τους γνωστούς αριθμούς οξείδωσης άλλων στοιχείων στην ένωση για να υπολογίσετε τον άγνωστο αριθμό οξείδωσης.
Παράδειγμα:
Ποιος είναι ο αριθμός οξείδωσης του θείου στο SO2;
* Το οξυγόνο έχει αριθμό οξείδωσης -2.
* Η ένωση είναι ουδέτερη, οπότε το άθροισμα των αριθμών οξείδωσης είναι 0.
* Έστω x ο αριθμός οξείδωσης του θείου.
* x + 2 (-2) =0
* x - 4 =0
* x =+4
Επομένως, ο αριθμός οξείδωσης του θείου στο SO2 είναι +4.
Θυμηθείτε: Είναι σημαντικό να εξεταστεί η συγκεκριμένη ένωση και η δομή της για να προσδιοριστούν ο αριθμός οξείδωσης ενός μη μέταλλου.