Νιτρικό Οξύ (HNO3) – Τύπος, Ιδιότητες, Μοριακή Μάζα &Χρήσεις
Το νιτρικό οξύ είναι ένας ισχυρός οξειδωτικός παράγοντας που περιέχει άτομα υδρογόνου, οξυγόνου και αζώτου. Παρασκευάζεται με την καταλυτική οξείδωση της αμμωνίας. Το νιτρικό οξύ είναι ένα εξαιρετικά χρήσιμο χημικό αντιδραστήριο στα εργαστήρια και στην κατασκευή εκρηκτικών και λιπασμάτων. Είναι ένα ισχυρό οξύ με pH περίπου 3,01. Εμφανίζεται ως υγρό που είναι άχρωμο έως κίτρινο. Με έντονη, ξεχωριστή όξινη οσμή, είναι εύκολο να αναγνωριστεί. Είναι πολύ διαβρωτικό αλλά βρίσκει εφαρμογές σε πολλές βιομηχανίες. Οι ακόλουθες ενότητες διερευνούν τη δομή του νιτρικού οξέος Lewis, τη μοριακή μάζα, τον τύπο νιτρικού οξέος, τις ιδιότητες και πολλά άλλα.
Τι είναι το νιτρικό οξύ;
Το νιτρικό οξύ είναι ένα ισχυρό οξύ. Είναι επίσης γνωστό με τα ακόλουθα ονόματα:
- πνεύμα νιτρών
- aqua fortis
Είναι ένα άχρωμο υγρό στην καθαρή του μορφή, αλλά κιτρινωπό καθώς μεγαλώνει. Το κίτρινο χυτό οφείλεται στην αποσύνθεση του νιτρικού οξέος σε νερό και οξείδια του αζώτου. Κατά το χειρισμό του νιτρικού οξέος πρέπει να λαμβάνονται τα κατάλληλα μέτρα ασφαλείας επειδή είναι εξαιρετικά διαβρωτικό και τοξικό. Μπορεί να προκαλέσει σοβαρά εγκαύματα σε επαφή με το δέρμα.
Τύπος και δομή νιτρικού οξέος
Ο τύπος για το νιτρικό οξύ είναι HNO3 . Περιέχει τα άτομα των παρακάτω στοιχείων:
- Τρία άτομα οξυγόνου
- Ένα άτομο αζώτου
- Ένα άτομο υδρογόνου
Το μόριο νιτρικού οξέος έχει ένα από τα τρία άτομα οξυγόνου του διπλά συνδεδεμένο με το κεντρικό άτομο αζώτου. Αντίθετα, το άλλο άτομο οξυγόνου συνδέεται με το κεντρικό άτομο αζώτου μέσω ενός μόνο δεσμού. Ένα άτομο οξυγόνου συνδέεται επίσης με ένα άτομο υδρογόνου μέσω ενός μόνο ομοιοπολικού δεσμού.
Φόρτιση στο μόριο νιτρικού οξέος: Το τρίτο άτομο οξυγόνου έχει φορτίο -1. Συνδέεται με το κεντρικό άτομο αζώτου. Το κεντρικό άτομο αζώτου σχηματίζει τέσσερις ομοιοπολικούς δεσμούς (3 με άτομα οξυγόνου και ένα με υδρογόνο). έχει +1 χρέωση. Έτσι, το καθαρό φορτίο στο μόριο είναι μηδέν.
Το θετικό φορτίο στο άζωτο ακυρώνεται από το αρνητικό φορτίο στο άτομο οξυγόνου. Επίσης, τα φορτία σε αυτό το μόριο μπορούν να μετατοπιστούν λόγω συντονισμού.
Νιτρικό οξύ Lewis Structure
Η παρακάτω εικόνα απεικονίζει τη δομή του νιτρικού οξέος Lewis με ομοιοπολικούς δεσμούς και μεμονωμένα ζεύγη. Το μόριο περιέχει 3 απλούς ομοιοπολικούς δεσμούς και έναν διπλό ομοιοπολικό δεσμό. Έχει επίσης επτά μεμονωμένα ζεύγη ηλεκτρονίων.
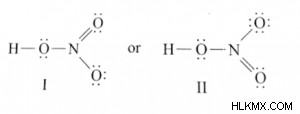
Μοριακή μάζα νιτρικού οξέος
Η μοριακή μάζα του νιτρικού οξέος μπορεί εύκολα να υπολογιστεί χρησιμοποιώντας τον χημικό τύπο και τις ατομικές μάζες των συστατικών του στοιχείων.
Ατομική μάζα Υδρογόνου =1u
Ατομική μάζα αζώτου =14 u
Ατομική μάζα Οξυγόνου =16u
Η μοριακή μάζα του νιτρικού οξέος (HNO3 ) θα υπολογιστεί ως εξής:
Μοριακή μάζα =(1 × ατομική μάζα υδρογόνου) + (1 × ατομική μάζα αζώτου) +( 3 × ατομική μάζα οξυγόνου)
Μοριακή μάζα =(1 × 1) +(1 × 14) + (3 × 16)
Μοριακή μάζα νιτρικού οξέος =63 u
Εργαστηριακή Παρασκευή Νιτρικού Οξέος
Στο εργαστήριο, το νιτρικό οξύ παρασκευάζεται με την αντίδραση θειικού οξέος με νιτρικό κάλιο.
Αρχή: Ένα οξύ που είναι πιο πτητικό μπορεί να εκτοπιστεί από το άλας του χρησιμοποιώντας ένα λιγότερο πτητικό οξύ. Εικονογράφηση: Το θειικό οξύ είναι λιγότερο πτητικό από το νιτρικό οξύ. Επομένως, μπορεί να εκτοπιστεί από νιτρικά μέταλλα χρησιμοποιώντας θειικό οξύ.
Αντιδρώντα: Τα ακόλουθα αντιδρώντα χρησιμοποιούνται στο κλάσμα:
- Νιτρικό κάλιο – 50 γραμμάρια
- Πυκνό θειικό οξύ – 25 ml
Διαδικασία: Τα αντιδρώντα τοποθετούνται σε φιάλη στρογγυλού πυθμένα και θερμαίνονται στους 200°C περίπου. Είναι ζωτικής σημασίας να διασφαλίσετε ότι η θερμοκρασία δεν υπερβαίνει τους 200°C.
Αντίδραση: KNO3 + H2 SO4 → KHSO4 + HNO3
(Αλάτι πιο πτητικού οξέος + λιγότερο πτητικό οξύ → Αλάτι + πιο πτητικό οξύ)
Συλλογή: Οι ατμοί του νιτρικού οξέος συλλέγονται. Συμπυκνώνονται για να δώσουν το διάλυμα νιτρικού οξέος.
Εμπορική παρασκευή νιτρικού οξέος
Τα διαλύματα νιτρικού οξέος του εμπορίου έχουν συγκέντρωση 52% έως 68%. Παρασκευάζονται μέσω της διαδικασίας Ostwald, όπου η άνυδρη αμμωνία οξειδώνεται σε μονοξείδιο του αζώτου. Η πλατίνα ή το ρόδιο χρησιμοποιείται ως καταλύτης για την αντίδραση. Διατηρείται υψηλή θερμοκρασία περίπου 500 K και πίεση 9 atm.
Αντιδρώντα: Αμμωνία και οξυγόνο
Καταλύτης: Πλατίνα
Αντίδραση: 4 NH3 (ζ) + 5 O2 (ζ) → 4 NO(g) + 6 H2 O(g)
Η αντίδραση περιλαμβάνει ενέργεια −905,2 kJ/mol.
Το μονοξείδιο του αζώτου που παράγεται στην πρώτη αντίδραση αντιδρά ξανά με το οξυγόνο για να σχηματίσει διοξείδιο του αζώτου.
2 NO(g) + O2 (ζ) → 2 ΟΧΙ2 (ζ)
Η αντίδραση περιλαμβάνει ενέργεια −114 kJ/mol.
Το διοξείδιο του αζώτου απορροφάται στο νερό για την παραγωγή νιτρικού οξέος ως εξής:
3 ΟΧΙ2 (ζ) + H2 O(l) → 2 HNO3 (aq) + NO(g)
Η αντίδραση περιλαμβάνει ενέργεια −135,74 kJ/mol.
Το μονοξείδιο του αζώτου που παράγεται στο προηγούμενο βήμα ανακυκλώνεται ξανά για επαναοξείδωση.
4 ΟΧΙ2 (ζ) + O2 (ζ) + 2 H2 O(l) → 4 HNO3 (aq)
Το υδατικό νιτρικό οξύ που λαμβάνεται αποστάζεται για να επιτευχθεί συγκέντρωση 68% κατά μάζα. Μπορεί να συμπυκνωθεί περαιτέρω έως και 98% με αφυδάτωση με πυκνό θειικό οξύ.
Φυσικές ιδιότητες του νιτρικού οξέος
Οι σημαντικές φυσικές ιδιότητες του νιτρικού οξέος είναι οι εξής:
- Μοριακή μάζα νιτρικού οξέος:63,01 g/mol
- Πυκνότητα:1,51 g/cm³
- Χρώμα:Άχρωμο έως κίτρινο
- Οσμή:Έντονη όξινη μυρωδιά
- Σημείο βρασμού:83 °C
- Σημείο τήξης:-42 °C
Χημικές ιδιότητες του νιτρικού οξέος
Είναι ένα ισχυρό οξύ που μετατρέπεται σε μπλε κόκκινο χρώμα. Δίνει όλα τα τεστ για οξέα. Ακολουθούν μερικές από τις σημαντικές χημικές αντιδράσεις που περιλαμβάνουν νιτρικό οξύ.
Αποσύνθεση
Το νιτρικό οξύ αποσυντίθεται εύκολα σε διοξείδιο του αζώτου σε παραμονή. Γίνεται από άχρωμο σε κίτρινο σε καφέ.
4 HNO3 → 4 ΟΧΙ2 + O2 + 2 H2 O
Αντίδραση με μέταλλα
Όταν το νιτρικό οξύ γίνεται να αντιδρά με μέταλλα, ελευθερώνει αέριο υδρογόνο. Ωστόσο, αυτή η αντίδραση είναι δυνατή μόνο με τα μέταλλα πάνω από το υδρογόνο στη σειρά αντιδραστικότητας.
Αντίδραση με μαγνήσιο: Mg + 2 HNO3 → Mg(ΟΧΙ3 )2 + H2
Αντίδραση με Μαγγάνιο: Mn + 2 HNO3 → Mn(ΟΧΙ3 )2 + H2
Το νιτρικό οξύ μπορεί επίσης να αντιδράσει με μη ενεργά μέταλλα όπως ο άργυρος και ο χαλκός, οξειδώνοντάς τα στη διαδικασία. Η αντίδραση εξαρτάται σε μεγάλο βαθμό από τη θερμοκρασία και τη συγκέντρωση του οξέος.
Αντίδραση με χαλκό: 3 Cu + 8 HNO3 → 3 Cu + 2 NO + 4 H2 O + 6 ΟΧΙ
Αντιδράσεις με αμέταλλα
Καθώς το νιτρικό οξύ είναι ένα ισχυρό οξειδωτικό οξύ, αντιδρά με διάφορα οργανικά υλικά. Αυτές οι αντιδράσεις μπορεί επίσης να είναι εκρηκτικές. Η ομάδα υδροξυλίου του οξέος θα αφαιρέσει τυπικά το υδρογόνο από το δεδομένο οργανικό μόριο και θα οδηγήσει σε σχηματισμό νερού, ενώ η νίτρο ομάδα πηδά στη θέση του υδρογόνου. Η κύρια διαδικασία σύνθεσης πολλών εκρηκτικών περιλαμβάνει τη νιτροποίηση οργανικών ενώσεων με νιτρικά οξέα, όπως το τρινιτροτολουόλιο (TNT) και η νιτρογλυκερίνη.
Σε αντίδραση με μη μεταλλικά στοιχεία, εκτός από άζωτο, οξυγόνο, ευγενή αέρια, αλογόνα (εκτός από ιώδιο) και πυρίτιο, τα οξειδώνει στην υψηλότερη κατάσταση οξείδωσης. Για παράδειγμα,
Αντίδραση πυκνού νιτρικού οξέος με άνθρακα :Δίνει διοξείδιο του αζώτου.
C (γραφίτης) + 4 HNO3 → CO2 + 4 ΟΧΙ2 + 2 H2 O
Αντίδραση αραιού νιτρικού οξέος με άνθρακα :Δίνει μονοξείδιο του αζώτου.
3 C (γραφίτης) + 4 HNO3 → 3 CO2 + 4 ΟΧΙ + 2 H2 O
Ξανθοπρωτεϊκή δοκιμή
Ένας συγκεκριμένος τύπος κίτρινου νιτρικού προϊόντος σχηματίζεται όταν το νιτρικό οξύ αντιδρά με πρωτεΐνες. Αυτή η αντίδραση ονομάζεται ξανθοπρωτεϊκή αντίδραση. Σε αυτή τη δοκιμή, προστίθεται πυκνό νιτρικό οξύ στην υπό δοκιμή ουσία και το μείγμα θερμαίνεται. Το μείγμα γίνεται κίτρινο εάν οι προστιθέμενες πρωτεΐνες περιέχουν αμινοξέα με αρωματικούς δακτυλίους. Το χρώμα αλλάζει σε πορτοκαλί όταν προστίθεται μια βάση στο μείγμα, όπως η αμμωνία. Οι νιτρωμένοι αρωματικοί δακτύλιοι που υπάρχουν στην πρωτεΐνη είναι υπεύθυνοι για αυτές τις χρωματικές αλλαγές. Όταν το νιτρικό οξύ έρχεται σε επαφή με τα επιθηλιακά κύτταρα, σχηματίζεται ξανθοπρωτεϊκό οξύ. Επομένως, λόγω αυτών των τοπικών αλλαγών στο χρώμα του δέρματος, πρέπει να λαμβάνονται οι κατάλληλες προφυλάξεις ασφαλείας κατά το χειρισμό του νιτρικού οξέος.
Χρήσεις νιτρικού οξέος
- Το νιτρικό οξύ χρησιμοποιείται στην παραγωγή νιτρικών αμμωνίων, τα οποία με τη σειρά τους χρησιμοποιούνται για την παραγωγή χρωστικών, πλαστικών και λιπασμάτων.
- HNO3 χρησιμοποιείται στην παραγωγή εκρηκτικών όπως TNT.
- Το νιτρικό οξύ χρησιμοποιείται ως οξειδωτικό σε πυραύλους με υγρά καύσιμα.
- Χρησιμοποιείται για την αφαίρεση των κονδυλωμάτων όταν είναι σε καθαρή μορφή.
- Το νιτρικό οξύ χρησιμοποιείται επίσης στην ηλεκτροχημεία ως χημικός παράγοντας ντόπινγκ.
Συχνές ερωτήσεις
1. Τι συμβαίνει όταν το νιτρικό οξύ αντιδρά με το νερό;
Α. Η2 του νερού είναι η βάση για την απομάκρυνση του Η+ από το νιτρικό οξύ. Το προκύπτον υδρόνιο H3 Το O+ είναι ένα συζευγμένο οξύ. Εδώ, η βάση του συζυγούς είναι ΟΧΙ3 , δηλ. Νιτρικό. Είναι ένα μόριο νιτρικού οξέος του οποίου το H+ αφαιρείται.
2. Το νιτρικό οξύ διαλύει κάποιο μέταλλο;
Α. Ναι, το νιτρικό οξύ οξειδώνει ορισμένα μέταλλα και κράματα. Ωστόσο, όταν υποβάλλονται σε επεξεργασία με πυκνό νιτρικό οξύ, ο χρυσός και η πλατίνα δεν επηρεάζονται. Ταυτόχρονα, ορισμένα μέταλλα παθητικοποιούνται από το νιτρικό οξύ. Αυτά τα μέταλλα διαλύονται χρησιμοποιώντας ένα αραιό νιτρικό διάλυμα ή ένα μείγμα οξέων.
3. Υπάρχει κάτι που εξουδετερώνει το νιτρικό οξύ;
Α. Ναι, το νιτρικό οξύ εξουδετερώνεται από διττανθρακικό νάτριο. Θεωρείται ότι ένα μέρος του διττανθρακικού νατρίου εξουδετερώνει ένα μέρος του νιτρικού οξέος. Στην πραγματικότητα, το 5 τοις εκατό του νιτρικού δεν είναι πολύ βαρύτερο από το H2 Ο. Επομένως, 100 γαλόνια αυτού του διαλύματος ισοδυναμούν με 834 λίβρες νιτρικού οξέος.




