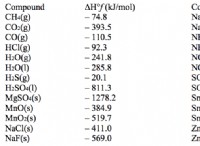
Γιατί μια ουσία μπορεί να διαλυθεί σε άλλη λύση μορφής;
1. Διαμοριακές δυνάμεις:
* αλληλεπιδράσεις διαλύτη: Τα μόρια του διαλύτη πρέπει να έχουν ισχυρή έλξη στα μόρια διαλυτής ουσίας. Αυτή η έλξη βασίζεται σε διαμοριακές δυνάμεις όπως η δέσμευση υδρογόνου, οι αλληλεπιδράσεις διπολικής-δίπολης ή οι δυνάμεις διασποράς του Λονδίνου.
* αλληλεπιδράσεις διαλυμένης διαλυτής ουσίας: Τα μόρια της διαλυμένης ουσίας πρέπει να είναι σε θέση να ξεφύγουν από το ένα το άλλο. Εάν τα μόρια της διαλυμένης ουσίας προσελκύονται πολύ έντονα ο ένας στον άλλο, δεν θα είναι σε θέση να διαλύονται.
2. Πολικότητα:
* όπως διαλύεται όπως: Αυτό είναι ένα κοινό ρητό στη χημεία. Οι πολικοί διαλύτες (όπως το νερό) τείνουν να διαλύουν τις πολικές διαλυμένες ουσίες (όπως η ζάχαρη), ενώ οι μη πολικοί διαλύτες (όπως το πετρέλαιο) τείνουν να διαλύουν τις μη πολικές διαλυμένες ουσίες (όπως το λίπος).
3. Εντροπία:
* Αυξημένη διαταραχή: Όταν διαλύεται μια διαλυμένη ουσία, γίνεται πιο διασκορπισμένη στον διαλύτη, οδηγώντας σε αύξηση της εντροπίας (διαταραχής) του συστήματος. Αυτή η αύξηση της εντροπίας ευνοεί τη διαδικασία διάλυσης.
4. Θερμοκρασία:
* Οι υψηλότερες θερμοκρασίες γενικά ευνοούν τη διάλυση: Η αυξημένη θερμοκρασία παρέχει περισσότερη ενέργεια για να ξεπεραστούν οι διαμοριακές δυνάμεις που συγκρατούν τη διαλυτή ουσία μαζί και επιτρέπουν στα μόρια του διαλύτη να κινούνται ταχύτερα, αυξάνοντας τις αλληλεπιδράσεις με τη διαλυμένη ουσία.
5. Πίεση:
* Η πίεση επηρεάζει κυρίως τη διάλυση των αερίων σε υγρά: Αυξημένη πίεση αναγκάζει περισσότερα μόρια αερίου σε διάλυμα. Αυτός είναι ο λόγος για τον οποίο το διοξείδιο του άνθρακα διαλύεται καλύτερα σε σόδα υπό υψηλότερη πίεση.
Παράδειγμα:
* Διάλυση ζάχαρης σε νερό: Η ζάχαρη είναι ένα πολικό μόριο και το νερό είναι ένας πολικός διαλύτης. Η δέσμευση υδρογόνου μεταξύ των μορίων του νερού και των υδροξυλομάδων στη ζάχαρη παρέχει ισχυρές αλληλεπιδράσεις διαλύματος διαλύτη. Τα μόρια ζάχαρης έχουν επίσης αρκετή ενέργεια για να σπάσουν το ένα από το άλλο, επιτρέποντάς τους να περιβάλλονται από μόρια νερού και διαλύονται.
Συνοπτικά:
Μια ουσία μπορεί να διαλυθεί σε μια άλλη ουσία εάν τα μόρια του διαλύτη έχουν έντονη έλξη στα μόρια διαλυμένης ουσίας, τα μόρια διαλυτής ουσίας μπορούν να απομακρυνθούν μεταξύ τους και η συνολική διαδικασία οδηγεί σε αύξηση της εντροπίας. Η πολικότητα του διαλύτη και η ουσία, καθώς και η θερμοκρασία και η πίεση, διαδραματίζουν επίσης σημαντικούς ρόλους.