Σε ποια κατάσταση οι ιοντικές ενώσεις και η ομοιοπολική συμπεριφορά ηλεκτρικής ενέργειας;
Ιωνικές ενώσεις
* Στερεά κατάσταση: Do όχι Διεξαγωγή ηλεκτρικής ενέργειας. Τα ιόντα κρατούνται σφιχτά σε ένα κρυσταλλικό πλέγμα και δεν μπορούν να κινηθούν ελεύθερα.
* Υγρή κατάσταση (τετηγμένη) : Διεξαγωγή ηλεκτρισμός. Όταν λιωθεί, τα ιόντα είναι ελεύθερα να μετακινηθούν και να μεταφέρουν το ηλεκτρικό ρεύμα.
* Υδατική λύση: Διεξαγωγή ηλεκτρισμός. Όταν διαλύονται σε νερό, τα ιόντα διαχωρίζονται και γίνονται κινητά, επιτρέποντας την ηλεκτρική αγωγιμότητα.
ομοιοπολικές ενώσεις
* Στερεά κατάσταση: Τα περισσότερα Μην Διεξαγωγή ηλεκτρικής ενέργειας. Οι ομοιοπολικές ενώσεις μοιράζονται ηλεκτρόνια και αυτά τα ηλεκτρόνια συνήθως εντοπίζονται στους δεσμούς, δεν είναι ελεύθερα να κινηθούν.
* Υγρή κατάσταση: Τα περισσότερα Μην Διεξαγωγή ηλεκτρικής ενέργειας. Παρόμοια με τη στερεά κατάσταση, τα ηλεκτρόνια εξακολουθούν να εντοπίζονται κυρίως στους δεσμούς.
* Υδατική λύση: Μερικά do Διεξάγετε ηλεκτρικό ρεύμα, αλλά μόνο αν είναι polar και Ionize στο νερό. Αυτό οφείλεται στο γεγονός ότι η διαδικασία ιονισμού δημιουργεί ιόντα που μπορούν στη συνέχεια να φέρουν το ρεύμα. Για παράδειγμα, το υδροχλωρικό οξύ (HCl) διαλύεται σε νερό για να σχηματίσει H+ και Cl-ions, καθιστώντας το αγώγιμο.
Συνοπτικά:
* Οι ιοντικές ενώσεις διεξάγουν ηλεκτρική ενέργεια στο τετηγμένο κατάσταση και σε υδατικά διαλύματα .
* Οι ομοιοπολικές ενώσεις γενικά δεν διεξάγουν ηλεκτρική ενέργεια, εκτός από πολικές ομοιοπολικές ενώσεις που ιονίζουν στο νερό.
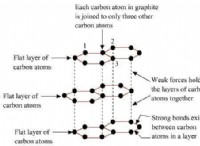
Σημείωση: Υπάρχουν κάποιες εξαιρέσεις από αυτούς τους γενικούς κανόνες. Για παράδειγμα, ο γραφίτης, μια μορφή άνθρακα, είναι μια ομοιοπολική ένωση που μπορεί να διεξάγει ηλεκτρική ενέργεια στη στερεά του κατάσταση λόγω της μοναδικής δομής της.