Γιατί τα περισσότερα μόρια έχουν ομοιοπολικούς δεσμούς;
* Κανόνας οκτάδων: Τα άτομα τείνουν να κερδίζουν, να χάνουν ή να μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση με οκτώ ηλεκτρόνια στο εξώτατο κέλυφος τους (κέλυφος σθένους). Αυτό είναι γνωστό ως κανόνας οκτάδων.
* Ηλεκτροργατιστικότητα: Διαφορετικά άτομα έχουν διαφορετικές ικανότητες για να προσελκύσουν ηλεκτρόνια. Οι ομοιοπολικοί δεσμοί σχηματίζονται όταν άτομα με παρόμοια ηλεκτροαρνητικά ηλεκτρόνια. Αντίθετα, οι ιοντικοί δεσμοί σχηματίζονται όταν υπάρχει σημαντική διαφορά στην ηλεκτροαρνητικότητα, με αποτέλεσμα να χάσει ένα άτομο και να κερδίσει ηλεκτρόνια.
* ελαχιστοποίηση ενέργειας: Οι ομοιοπολικοί δεσμοί είναι γενικά ισχυρότεροι από τους ιοντικούς δεσμούς, επειδή τα κοινόχρηστα ηλεκτρόνια είναι πιο κοντά στους πυρήνες και των δύο ατόμων, δημιουργώντας μια πιο σταθερή διάταξη. Αυτή η χαμηλότερη ενεργειακή κατάσταση καθιστά τους ομοιοπολικούς δεσμούς πιο ευνοϊκούς.
Παραδείγματα:
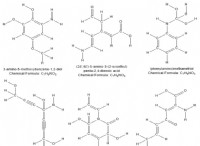
* νερό (h₂o): Τα άτομα υδρογόνου και οξυγόνου μοιράζονται ηλεκτρόνια για να σχηματίσουν ομοιοπολικούς δεσμούς.
* διοξείδιο του άνθρακα (CO₂): Τα άτομα άνθρακα και οξυγόνου μοιράζονται ηλεκτρόνια σε διπλούς ομοιοπολικούς δεσμούς.
* μεθάνιο (ch₄): Τα άτομα άνθρακα και υδρογόνου μοιράζονται ηλεκτρόνια σε μεμονωμένους ομοιοπολικούς δεσμούς.
Εξαιρέσεις:
Ενώ τα περισσότερα μόρια έχουν ομοιοπολικούς δεσμούς, υπάρχουν ορισμένες εξαιρέσεις:
* Ιωνικές ενώσεις: Αυτές οι ενώσεις αποτελούνται από αντίθετα φορτισμένα ιόντα που συγκρατούνται με ηλεκτροστατική έλξη (ιοντικοί δεσμοί), όπως NaCl (επιτραπέζιο αλάτι).
* Μεταλλικοί δεσμοί: Στα μέταλλα, τα ηλεκτρόνια απομακρύνονται και μοιράζονται καθ 'όλη τη διάρκεια της δομής, οδηγώντας σε μοναδικές ιδιότητες όπως η υψηλή αγωγιμότητα.
Συνοπτικά: Οι ομοιοπολικοί δεσμοί είναι ο πιο διαδεδομένος τύπος δεσμού σε μόρια επειδή επιτρέπουν στα άτομα να επιτύχουν μια σταθερή διαμόρφωση οκτάδων με κοινή χρήση ηλεκτρονίων. Αυτό οδηγεί σε χαμηλότερη ενεργειακή κατάσταση, καθιστώντας τους πιο ενεργά ευνοϊκούς από τους ιοντικούς δεσμούς.