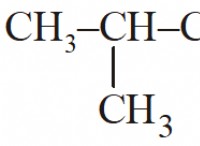Πώς επηρεάζουν οι πολικοί και μη δεσμοί διαλυτότητας;
Πώς επηρεάζουν οι πολικοί και μη πολικοί δεσμοί διαλυτότητας:ο κανόνας "όπως διαλύεται"
Η διαλυτότητα μιας ουσίας είναι η ικανότητά της να διαλύεται σε άλλη ουσία. Αυτό επηρεάζεται σε μεγάλο βαθμό από τους τύπους δεσμών μέσα σε κάθε μόριο, συγκεκριμένα αν είναι πολικές ή μη πολικές. Η βασική αρχή είναι:
"Όπως διαλύεται όπως"
Αυτό σημαίνει ότι οι ουσίες με παρόμοιες πολικότητες τείνουν να διαλύονται καλά μεταξύ τους.
Εδώ είναι μια κατανομή:
1. Πολικοί δεσμοί και πολικά μόρια:
* πολικοί δεσμοί: Εμφανίζονται όταν δύο άτομα με διαφορετικά ηλεκτρόνια μερίδια ηλεκτροαρνητικότητας, δημιουργώντας ένα ελαφρύ θετικό φορτίο στο ένα άκρο και ένα ελαφρύ αρνητικό φορτίο από την άλλη. Παραδείγματα περιλαμβάνουν δεσμούς H-O, H-N και C-O.
* πολικά μόρια: Μόρια με πολικούς δεσμούς που δημιουργούν μια συνολική ανομοιογενή κατανομή του φορτίου, δημιουργώντας ένα θετικό και αρνητικό "τέλος" στο μόριο.
* Διαλυτότητα: Τα πολικά μόρια τείνουν να διαλύονται καλά σε άλλους πολικούς διαλύτες (όπως το νερό), καθώς τα αντίθετα φορτία προσελκύουν και σχηματίζουν δεσμούς υδρογόνου.
2. Μη πολικοί δεσμοί και μη πολικά μόρια:
* Μη πολικοί δεσμοί: Εμφανίζονται όταν δύο άτομα με παρόμοια ηλεκτροαρνητικότητα μοιράζονται τα ηλεκτρόνια εξίσου, με αποτέλεσμα να μην υπάρχει καθαρή φόρτιση στο μόριο. Παραδείγματα περιλαμβάνουν ομόλογα C-H, C-C.
* Μη πολικά μόρια: Μόρια με μη πολικούς δεσμούς, με αποτέλεσμα την ομοιόμορφη κατανομή του φορτίου και χωρίς ξεχωριστά θετικά ή αρνητικά άκρα.
* Διαλυτότητα: Τα μη πολωτικά μόρια τείνουν να διαλύονται καλά σε άλλους μη πολικούς διαλύτες (όπως το πετρέλαιο), καθώς αλληλεπιδρούν μέσω αδύναμων δυνάμεων van der Waals.
Παραδείγματα:
* νερό (h₂o) είναι ένα πολικό μόριο με ισχυρούς δεσμούς υδρογόνου, καθιστώντας το καλό διαλύτη για άλλα πολικά μόρια όπως τα σάκχαρα και οι αλκοόλες.
* Λάδι (υδρογονάνθρακες) είναι ένα μη πολικό μόριο με αδύναμες δυνάμεις van der Waals, καθιστώντας το καλό διαλύτη για άλλα μη πολωτικά μόρια όπως τα λίπη και τα κεριά.
* αλάτι (NaCl) είναι μια ιοντική ένωση (πλήρως φορτισμένη) και διαλύεται καλά σε πολικό νερό λόγω ισχυρών ηλεκτροστατικών αλληλεπιδράσεων.
Εξαιρέσεις:
* αμφιναθικά μόρια: Έχουν τόσο πολικές όσο και μη πολικές περιοχές (όπως σαπούνι). Μπορούν να λειτουργήσουν ως "γέφυρες" για να βοηθήσουν να αναμειγνύουν πολικές και μη πολικές ουσίες, όπως το γράσο και το νερό.
* Θερμοκρασία: Η διαλυτότητα μπορεί να επηρεαστεί από τη θερμοκρασία. Οι υψηλότερες θερμοκρασίες αυξάνουν συνήθως τη διαλυτότητα για τις περισσότερες ουσίες.
Συνοπτικά:
Ο κανόνας "όπως διαλύεται" είναι ένα ισχυρό εργαλείο για την κατανόηση της διαλυτότητας. Αναγνωρίζοντας εάν μια ουσία είναι πολική ή μη πολική, μπορείτε να προβλέψετε εάν θα διαλύεται καλά σε ένα δεδομένο διαλύτη. Αυτή η κατανόηση είναι κρίσιμη σε διάφορες εφαρμογές, συμπεριλαμβανομένου του καθαρισμού, της ιατρικής και των χημικών αντιδράσεων.