Ποιες είναι οι ελκυστικές δυνάμεις μεταξύ των ατόμων σε μόρια;
1. Ενδομοριακοί δεσμοί (εντός του μορίου):
* ομοιοπολικοί δεσμοί: Αυτοί είναι οι ισχυρότεροι τύποι χημικών δεσμών, που σχηματίζονται από την ανταλλαγή ηλεκτρονίων μεταξύ των ατόμων. Μπορούν να είναι:
* μη πολικά ομοιοπολικά ομόλογα: Ίση κατανομή των ηλεκτρονίων μεταξύ πανομοιότυπων ατόμων (π.χ., Η2, Ο2).
* πολικοί ομοιοπολικοί δεσμοί: Η άνιση κατανομή των ηλεκτρονίων μεταξύ διαφορετικών ατόμων λόγω των διαφορών ηλεκτροαρνητικότητας (π.χ., HCl, H2O).
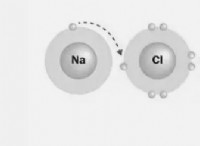
* Ιονικά ομόλογα: Αυτά περιλαμβάνουν την πλήρη μεταφορά ηλεκτρονίων από το ένα άτομο στο άλλο, με αποτέλεσμα τον σχηματισμό ιόντων με αντίθετες χρεώσεις. Η ηλεκτροστατική έλξη μεταξύ αυτών των ιόντων τα συγκρατεί (π.χ. NaCl).
* Μεταλλικοί δεσμοί: Αυτά συμβαίνουν σε μέταλλα, όπου τα ηλεκτρόνια είναι απομακρυσμένα και ελεύθερα να κινούνται σε όλο το μεταλλικό πλέγμα, δημιουργώντας μια ισχυρή ηλεκτροστατική έλξη μεταξύ των θετικά φορτισμένων μεταλλικών ιόντων και της ηλεκτρονικής θάλασσας.
2. Διαμοριακές δυνάμεις (μεταξύ μορίων):
Αυτές είναι ασθενέστερες δυνάμεις σε σύγκριση με τους χημικούς δεσμούς, αλλά εξακολουθούν να διαδραματίζουν σημαντικό ρόλο στον προσδιορισμό των φυσικών ιδιοτήτων των ουσιών. Περιλαμβάνουν:
* δεσμός υδρογόνου: Ένας ειδικός τύπος αλληλεπίδρασης διπολικής-διπόλης που συμβαίνει όταν ένα άτομο υδρογόνου συνδέεται με ένα εξαιρετικά ηλεκτροαρνητικό άτομο (όπως το οξυγόνο, το άζωτο ή η φθορίνη). Αυτό δημιουργεί μια ισχυρή έλξη μεταξύ του μερικώς θετικού ατόμου υδρογόνου και του μερικώς αρνητικού ζεύγους ηλεκτρονίων στο άλλο μόριο.
* Δυνάμεις διπόλης: Αυτά συμβαίνουν μεταξύ πολικών μορίων, όπου το μερικό θετικό τέλος ενός μορίου προσελκύει το μερικό αρνητικό άκρο ενός άλλου μορίου.
* Δυνάμεις διασποράς του Λονδίνου: Αυτά είναι αδύναμα, προσωρινά αξιοθέατα που συμβαίνουν μεταξύ όλων των μορίων, συμπεριλαμβανομένων των μη πολικών μορίων. Προκύπτουν λόγω των στιγμιαίων διακυμάνσεων της κατανομής των ηλεκτρονίων, δημιουργώντας προσωρινά διπόλια.
* Δυνάμεις ιόντων: Αυτά συμβαίνουν μεταξύ ιόντων και πολικών μορίων. Το ιόν θα προσελκύσει το αντίθετα φορτισμένο τέλος του πολικού μορίου.
Η δύναμη αυτών των δυνάμεων υπαγορεύει πολλές ιδιότητες των μορίων, όπως:
* σημείο βρασμού: Οι ισχυρότερες διαμοριακές δυνάμεις οδηγούν σε υψηλότερα σημεία βρασμού.
* Σημείο τήξης: Παρόμοια με το σημείο βρασμού, οι ισχυρότερες δυνάμεις οδηγούν σε υψηλότερα σημεία τήξης.
* Διαλυτότητα: Τα μόρια με παρόμοιες διαμοριακές δυνάμεις είναι πιο πιθανό να διαλυθούν μεταξύ τους.
* ιξώδες: Τα υγρά με ισχυρότερες διαμοριακές δυνάμεις είναι πιο ιξώδη.
Η κατανόηση αυτών των ελκυστικών δυνάμεων είναι ζωτικής σημασίας για την κατανόηση της συμπεριφοράς των μορίων και των ιδιοτήτων της ύλης.