Ιωνικός δεσμός ή ηλεκτρικός δεσμός
Ο ιονικός δεσμός είναι ένας δεσμός μεταξύ ενός μετάλλου και ενός μη μετάλλου που λειτουργεί ως ισχυρή ηλεκτροστατική έλξη για να διατηρεί αντίθετα φορτισμένα ιόντα . Ένας ηλεκτροσθενής δεσμός σχηματίζεται όταν τα ηλεκτρόνια μεταφέρονται από το εξωτερικό περίβλημα ενός μετάλλου στο εξώτατο κέλυφος ενός μη μετάλλου.
Τα μέταλλα που εμπλέκονται στο σχηματισμό ενός ιοντικού δεσμού θα πρέπει να έχουν χαμηλό Δυναμικό Ιοντισμού, ενώ τα αμέταλλα θα πρέπει να έχουν υψηλή Συγγένεια Ηλεκτρονίων. Το δυναμικό ιονισμού είναι η ποσότητα ενέργειας που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από το εξωτερικό περίβλημα ενός απομονωμένου αέριου ατόμου. Τέλος, η συγγένεια ηλεκτρονίων ορίζεται ως η ποσότητα ενέργειας που απελευθερώνεται όταν ένα ηλεκτρόνιο προστίθεται στο εξώτατο κέλυφος ενός απομονωμένου αέριου ατόμου.
Ιωνικός δεσμός ή ηλεκτρικός δεσμός
Σχηματίζεται μια χημική σύνδεση μεταξύ δύο ατόμων όταν ένα ή περισσότερα ηλεκτρόνια μεταφέρονται πλήρως από το ένα στο άλλο, με αποτέλεσμα τα άτομα να επιτύχουν την πλησιέστερη διαμόρφωση αδρανούς αερίου.
Με έναν από τους τρεις τρόπους, δύο άτομα μπορούν να χάσουν ενέργεια και να γίνουν σταθερά. Μπορούν να δωρίσουν ή να δεχτούν ηλεκτρόνια για να ολοκληρώσουν την οκτάδα τους. Το αποτέλεσμα ενός τέτοιου συνδυασμού είναι ένας ιοντικός δεσμός, γνωστός και ως ηλεκτροσθενής δεσμός. Το άλλο άτομο χάνει ηλεκτρόνια όταν ένα άτομο αποκτά ηλεκτρόνια από το εξώτατο επίπεδο ή την τροχιά του.
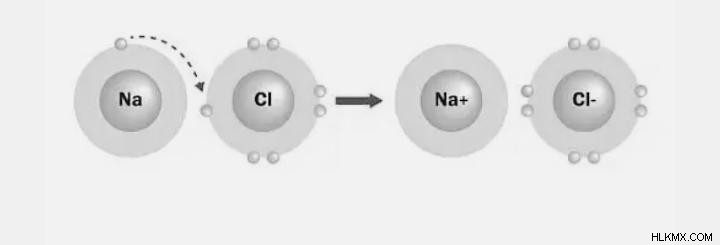
Ιωνικός δεσμός
Τα θετικά και αρνητικά ιόντα δημιουργούνται όταν τα ηλεκτρόνια μεταφέρονται από το ένα άτομο στο άλλο. Όταν τα ηλεκτρόνια μεταφέρονται μεταξύ δύο ατόμων, σχηματίζεται ο ηλεκτροσθενής σύνδεσμος, γνωστός και ως ιονικός δεσμός. Τα μόνα υλικά που μπορούν να σχηματίσουν ηλεκτροσθενείς δεσμούς είναι τα μέταλλα και τα αμέταλλα. Δεν σχηματίζεται ηλεκτρικός δεσμός μεταξύ μη μετάλλων.
Με απλούς όρους, μια ηλεκτροσθενής σύνδεση σχηματίζεται όταν ένα άτομο μεταφέρει έναν συγκεκριμένο αριθμό ηλεκτρονίων σε ένα άλλο άτομο με τάση για απόκτηση ηλεκτρονίων, με αποτέλεσμα το σχηματισμό σταθερών διαμορφώσεων αδρανούς αερίου και για τα δύο άτομα. Η δυναμική ενέργεια μιας ηλεκτροστατικής έλξης μειώνεται πάντα. Ως αποτέλεσμα, η δυναμική ενέργεια του συστήματος είναι πολύ χαμηλότερη από ό,τι ήταν πριν από το σχηματισμό μιας ιοντικής σύνδεσης.
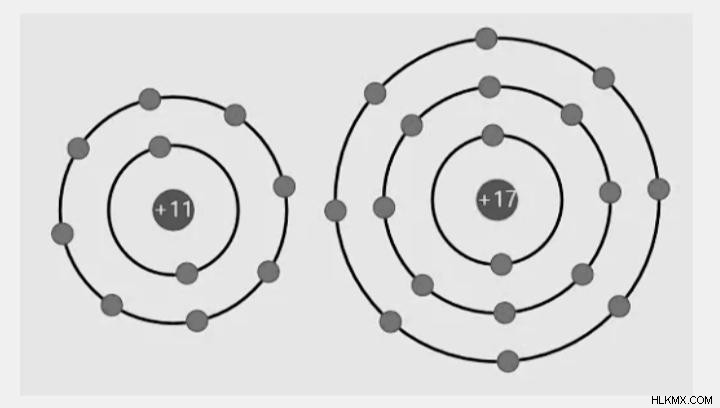
Τα μέταλλα και τα αμέταλλα έχουν ιοντικό δεσμό.
Χαρακτηριστικά του ιοντικού δεσμού
Σχηματίζεται ένας ιοντικός δεσμός όταν όλα τα ηλεκτρόνια σθένους μεταφέρονται για να επιτευχθεί σταθερότητα.
Αυτό το είδος δεσμού έχει ως αποτέλεσμα τον σχηματισμό δύο αντίθετα φορτισμένων ιόντων, θετικών κατιόντων και αρνητικών ανιόντων.
Μεταξύ δύο αντίθετα φορτισμένων ιόντων, υπάρχει μια ισχυρή δύναμη έλξης.
Αυτή η δύναμη είναι γνωστή ως ιονικός ή ηλεκτροσθενής δεσμός.
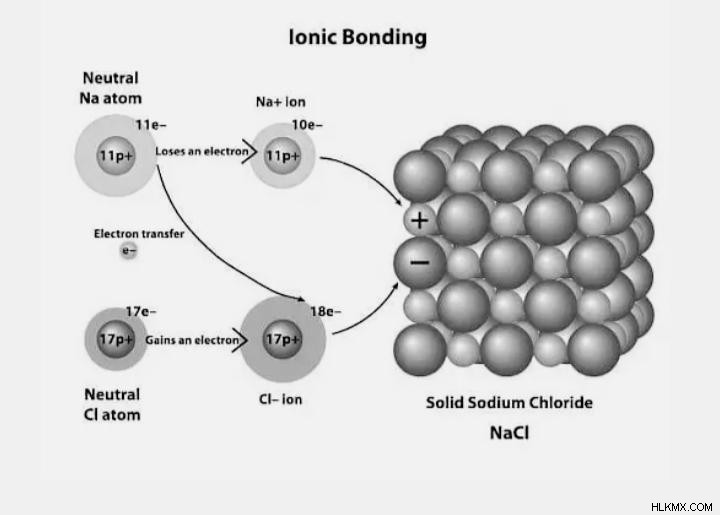
Δομή ιοντικού δεσμού
Όταν οι διαφορές ηλεκτραρνητικότητας είναι μεγάλες, σχηματίζονται ιοντικοί δεσμοί και όταν οι διαφορές ηλεκτραρνητικότητας είναι μικρές, σχηματίζονται ομοιοπολικοί δεσμοί.
Οι ιοντικές ενώσεις αποτελούνται από θετικά και αρνητικά ιόντα που έλκονται ηλεκτροστατικά το ένα από το άλλο.
Ιδιότητες του ιοντικού δεσμού
Οι ιδιότητες ενός ιοντικού δεσμού είναι οι εξής:
Ο ιοντικός δεσμός είναι ο πιο ισχυρός από όλους τους δεσμούς.
Όπως γνωρίζουμε ότι οι ιοντικοί δεσμοί περιλαμβάνουν διαχωρισμό φορτίου, είναι οι πιο αντιδραστικοί από όλους τους δεσμούς στο σωστό μέσο.
Οι ενώσεις ιοντικών δεσμών έχουν υψηλά σημεία τήξης και βρασμού.
Στα υδατικά διαλύματά τους ή την τετηγμένη τους κατάσταση, τα συνδεδεμένα με ιοντικά μόρια είναι εξαιρετικοί αγωγοί του ηλεκτρισμού. Αυτό οφείλεται στην παρουσία ιόντων, τα οποία λειτουργούν ως φορείς φορτίου.
Συμπέρασμα
Ένας ιοντικός δεσμός είναι ένας δεσμός μεταξύ ενός μετάλλου και ενός μη μετάλλου που λειτουργεί ως ισχυρή ηλεκτροστατική έλξη για να διατηρεί μαζί τα αντίθετα φορτισμένα ιόντα. Ένας ηλεκτροσθενής δεσμός σχηματίζεται όταν τα ηλεκτρόνια μεταφέρονται από το εξωτερικό περίβλημα ενός μετάλλου στο εξώτατο κέλυφος ενός μη μετάλλου.
Τα θετικά και αρνητικά ιόντα δημιουργούνται όταν τα ηλεκτρόνια μεταφέρονται από το ένα άτομο στο άλλο. Όταν τα ηλεκτρόνια μεταφέρονται μεταξύ δύο ατόμων, σχηματίζεται ο ηλεκτροσθενής σύνδεσμος, γνωστός και ως ιονικός δεσμός. Τα μόνα υλικά που μπορούν να σχηματίσουν ηλεκτροσθενείς δεσμούς είναι τα μέταλλα και τα αμέταλλα.
Τα άτομα στοιχείων συχνά χάνουν, κερδίζουν ή μοιράζονται ηλεκτρόνια με άλλα άτομα για να επιτύχουν την ίδια δομή ηλεκτρονίων με το επόμενο σπάνιο αέριο με δύο ηλεκτρόνια στο εξωτερικό επίπεδο. Ο κανόνας Duplet είναι το όνομα αυτού.
Τα άτομα στοιχείων συχνά χάνουν, κερδίζουν ή μοιράζονται ηλεκτρόνια με άλλα άτομα για να επιτύχουν την ίδια δομή ηλεκτρονίων με το πλησιέστερο σπάνιο αέριο με οκτώ ηλεκτρόνια στο εξωτερικό επίπεδο. Ο κανόνας Octet είναι το όνομα αυτού.
Σχηματίζεται μια ιοντική ένωση όταν άτομα μετάλλων από τις ομάδες 1 και 2 στον περιοδικό πίνακα χάνουν ηλεκτρόνια σε άτομα αμέταλλων από τις ομάδες 5 έως 7 στον περιοδικό πίνακα για να ολοκληρώσουν τη σταθερή ηλεκτρονική τους διαμόρφωση, σύμφωνα με ο κανόνας Duplet ή Octet. Τα πρωτόνια αυτών των ατόμων παραμένουν αναλλοίωτα κατά τη διάρκεια αυτών των μεταφορών ηλεκτρονίων.