Γιατί το χλώριο είναι ενεργό μη μέταλλο;
1. Διαμόρφωση ηλεκτρονίων και ηλεκτροαρνητικότητα:
* Το χλώριο έχει επτά ηλεκτρόνια στο εξωτερικό κέλυφος του, που σημαίνει ότι χρειάζεται μόνο ένα ακόμη ηλεκτρόνιο για να επιτύχει ένα σταθερό οκτάτο. Αυτή η έντονη επιθυμία για ένα επιπλέον ηλεκτρόνιο το καθιστά εξαιρετικά ηλεκτροαρνητικό.
* Η ηλεκτροαρνητικότητα είναι η τάση ενός ατόμου να προσελκύει ηλεκτρόνια προς τον εαυτό του. Το χλώριο έχει υψηλή ηλεκτροαρνητικότητα (3,16 στην κλίμακα Pauling), υποδεικνύοντας την ισχυρή του έλξη στα ηλεκτρόνια.
2. Αντιδραστικότητα:
* Λόγω της υψηλής ηλεκτροαρνητικότητάς του, το χλώριο σχηματίζει εύκολα χημικούς δεσμούς με άλλα στοιχεία, ειδικά μέταλλα. Αυτή η αντιδραστικότητα είναι ο λόγος για τον οποίο το χλώριο χρησιμοποιείται ως απολυμαντικό και λευκαντικό, καθώς αντιδρά με οργανικές ενώσεις και τις σπάει.
* Το χλώριο σχηματίζει εύκολα ιοντικούς δεσμούς με μέταλλα, σχηματίζοντας άλατα όπως το χλωριούχο νάτριο (NaCl).
* Επίσης σχηματίζει ομοιοπολικούς δεσμούς με μη μέταλλα, όπως στο σχηματισμό υδρογόνου (HCl).
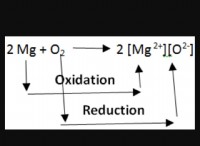
3. Καταστάσεις οξείδωσης:
* Το χλώριο μπορεί να υπάρχει σε διάφορες καταστάσεις οξείδωσης, που κυμαίνονται από -1 (πιο συνηθισμένες) έως +7, υποδεικνύοντας την ικανότητά του να κερδίζει ή να χάνει ηλεκτρόνια κατά τη διάρκεια χημικών αντιδράσεων. Αυτή η ευελιξία συμβάλλει περαιτέρω στην αντιδραστικότητα της.
4. Ύπαρξη ως διατομικό μόριο:
* Το χλώριο υπάρχει ως διατομικό μόριο (CL2) στη στοιχειακή του μορφή. Αυτό το μόριο είναι εξαιρετικά αντιδραστικό λόγω του αδύναμου δεσμού μεταξύ των δύο ατόμων χλωρίου, τα οποία μπορούν εύκολα να σπάσουν για να σχηματίσουν νέους δεσμούς με άλλα στοιχεία.
5. Αντιδράσεις με νερό:
* Το χλώριο αντιδρά με νερό (H2O) για να σχηματίσει υποχλωριώδες οξύ (HOCL), έναν ισχυρό οξειδωτικό παράγοντα που είναι υπεύθυνος για τις ιδιότητες απολύμανσης του.
Συνοπτικά: Η υψηλή ηλεκτροαρνητικότητα του χλωρίου, η ισχυρή αντιδραστικότητα, οι ποικίλες καταστάσεις οξείδωσης, η διατομική φύση και η ικανότητα σχηματισμού ισχυρών οξειδωτικών παραγόντων καθιστούν ένα εξαιρετικά ενεργό μέταλλο.