Αδιαβατική Επέκταση
Η θερμοδυναμική αναφέρεται στην κίνηση της θερμικής ενέργειας μεταξύ ενός συστήματος και του περιβάλλοντός του και στη μετατροπή της θερμότητας σε μηχανική ενέργεια και αντίστροφα.
Θερμοδυναμικό σύστημα
Ένα θερμοδυναμικό σύστημα είναι μια συλλογή μορίων ή ατόμων που περιέχονται σε μια περιοχή υπό συγκεκριμένη πίεση (P), όγκο (V) και θερμοκρασία (T), που είναι οι θεμελιώδεις ιδιότητες αυτού του συστήματος.
Ο όρος "περιβάλλον" αναφέρεται σε οτιδήποτε εκτός αυτού του συστήματος ανταλλάσσει θερμότητα ή μάζα. Με βάση τη διασύνδεση ενός συστήματος με το περιβάλλον του, τα θερμοδυναμικά συστήματα κατηγοριοποιούνται σε τρεις ομάδες:
(α) Ανοιχτό σύστημα:Ένα ανοιχτό σύστημα είναι αυτό στο οποίο τόσο η θερμότητα όσο και η μάζα ανταλλάσσονται με το περιβάλλον ή το περιβάλλον του συστήματος.
(β) Κλειστό σύστημα:Ένα σύστημα θεωρείται κλειστό εάν ανταλλάσσει μόνο θερμότητα και καθόλου μάζα με το περιβάλλον ή το περιβάλλον του.
(γ) Απομονωμένο σύστημα:Ένα σύστημα θεωρείται απομονωμένο εάν δεν υπάρχει ανταλλαγή θερμότητας ή μάζας με το περιβάλλον ή το περιβάλλον.
Νόμοι της Θερμοδυναμικής
Οι νόμοι της θερμοδυναμικής είναι οι εξής:-
Μηδενικός νόμος της θερμοδυναμικής :
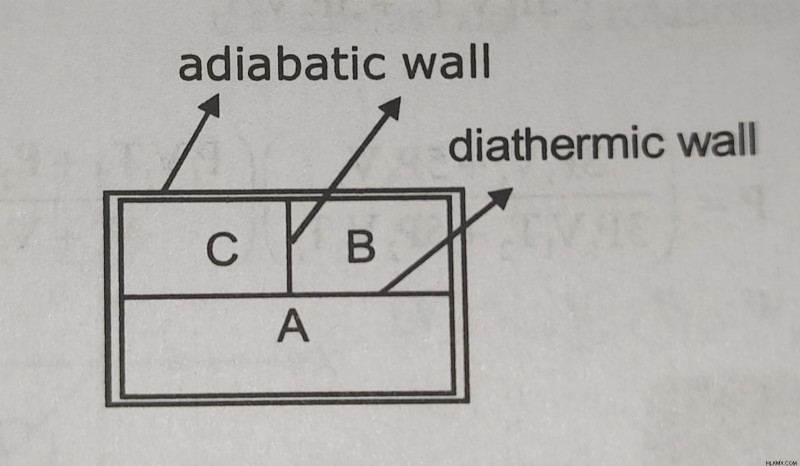
Εάν δύο συστήματα (Β και Γ) βρίσκονται σε θερμική ισορροπία με ένα τρίτο σύστημα (Α), τότε το Β και το Γ λέγεται ότι βρίσκονται σε θερμική ισορροπία μεταξύ τους.
Πρώτος νόμος της θερμοδυναμικής:
Ο πρώτος νόμος της θερμοδυναμικής είναι συχνά γνωστός ως νόμος διατήρησης της ενέργειας. Ισχυρίζεται ότι όταν ένα σύστημα απορροφά θερμότητα dQ, η θερμότητα μετατρέπεται σε εσωτερική ενέργεια dU και σε dW εργασίας για το σύστημα. Τότε dQ =dU + dW
Όμως, dW =PdV
Στη συνέχεια, dQ =dU + PdV
που είναι ο πρώτος νόμος της θερμοδυναμικής μαθηματική εξίσωση.
Όταν ένα σύστημα αποκτά θερμότητα, τόσο η εργασία που γίνεται από το σύστημα όσο και η αύξηση της εσωτερικής του ενέργειας θεωρούνται θετικές.
Από την άλλη πλευρά, όταν ένα σύστημα χάνει θερμότητα, η εργασία που γίνεται σε αυτό μαζί με τη μείωση της εσωτερικής του ενέργειας θεωρείται αρνητική.
Δεύτερος θερμοδυναμικός νόμος :
Αυτός ο νόμος καθορίζει την κατεύθυνση προς την οποία κινείται η θερμότητα.
Σύμφωνα με τον Classius, είναι αδύνατο να σχεδιαστεί μια μηχανή που μπορεί να μεταφέρει θερμότητα από ένα αντικείμενο χαμηλότερης θερμοκρασίας σε ένα συγκριτικά υψηλότερο, χωρίς τη βοήθεια εξωτερικής πηγής.
Σύμφωνα με τη δήλωση Kelvin-Planck, δεν υπάρχει μηχανή που να μπορεί να αναπτυχθεί που να λειτουργεί με μια κυκλική διαδικασία, να λαμβάνει θερμότητα από μια πηγή, να τη μετατρέπει σε εργασία και να μην απορρίπτει θερμότητα για να βυθιστεί. Για να το θέσω απλά, κανένα μηχάνημα δεν μπορεί να εκτελέσει το 100% της εργασίας.
Εξίσωση κατάστασης (για ιδανικά αέρια)
Η εξίσωση κατάστασης είναι η σχέση μεταξύ των P,V,T του θερμοδυναμικού συστήματος. PV =nRT είναι η εξίσωση κατάστασης για ένα ιδανικό αέριο με n moles.
Οι παράμετροι P, V και T είναι επίσης γνωστές ως θερμοδυναμικές μεταβλητές.
Εργασία που γίνεται από αέριο
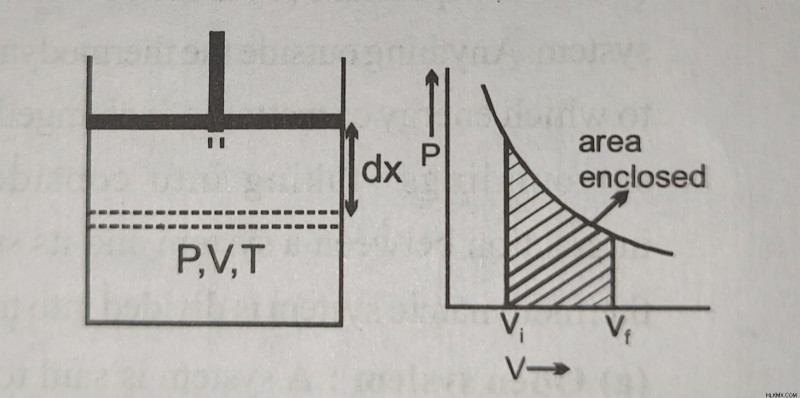
Ο όγκος (V) και η πίεση (P) του αερίου και η περιοχή του εμβόλου (A) χρησιμοποιούνται για τον υπολογισμό της δύναμης που ασκείται στο έμβολο από το αέριο. Ο τύπος για τον υπολογισμό του είναι F =PA.
Αφήστε το έμβολο να διανύσει μια μέτρια απόσταση dx κατά τη διάρκεια της διαστολής αερίου.
dW =Fdx =PAdx είναι η εργασία που γίνεται για μια μικρή μετατόπιση dx.
Εφόσον A dx =dV, η αύξηση του όγκου του αερίου είναι dV.
⇒ dW =P dV
ή W =∫ dW =∫ PdV
Η εργασία που γίνεται κατά τη διάρκεια της διαδικασίας αντιπροσωπεύεται από την περιοχή που περιέχεται από την καμπύλη P-V.
Έννοια της αδιαβατικής διαστολής
Εάν δεν παρέχεται θερμότητα ή δεν λαμβάνεται από ένα σύστημα, λέγεται ότι είναι αδιαβατικό. Η θερμοκρασία αλλάζει σε αυτή την κατάσταση χωρίς να προσθέτει θερμότητα. Σε αυτόν τον τύπο διαδικασίας, η μοριακή θερμοχωρητικότητα είναι
Καδιαβατικό =△Q / n△T =μηδέν
Η εσωτερική ενέργεια του αερίου μειώνεται ως αποτέλεσμα της εργασίας που κάνει σε αυτή τη διαδικασία. Όταν ένα αέριο που περικλείεται σε ένα δοχείο με αδιαβατικά τοιχώματα διαστέλλεται, η εσωτερική ενέργεια του συστήματος μειώνεται και η θερμοκρασία πέφτει. Η θερμοκρασία αυξάνεται όταν το αέριο συμπιέζεται αδιαβατικά.
Η εξίσωση για την αδιαβατική διαδικασία είναι:
PV𝜸 =σταθερά [Νόμος Poission]
T𝜸 P1 – 𝜸 =σταθερό
T V𝜸 – 1 =σταθερό
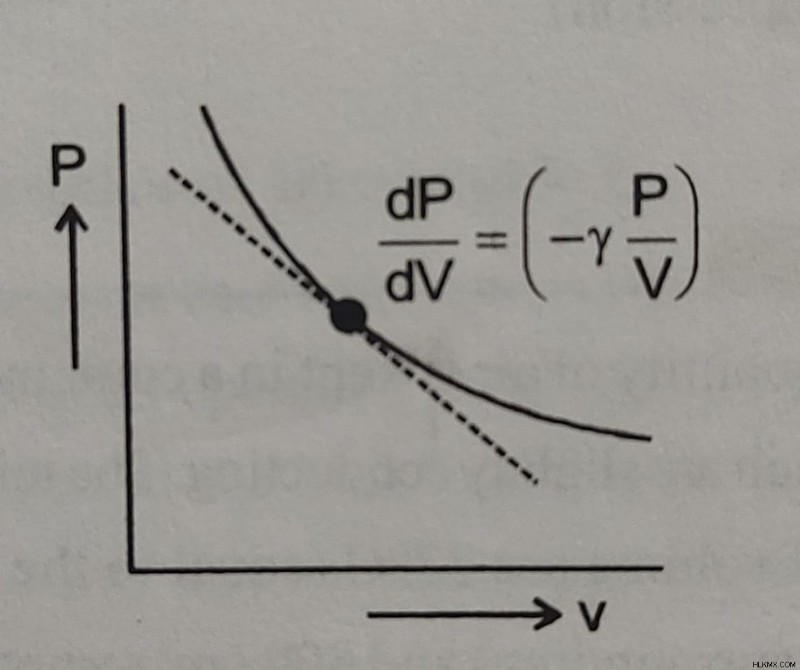
Κλίση καμπύλης P-V σε αδιαβατική διαστολή :
Αφού PV𝜸 =σταθερό
dp / dV =-𝜸(P / V)
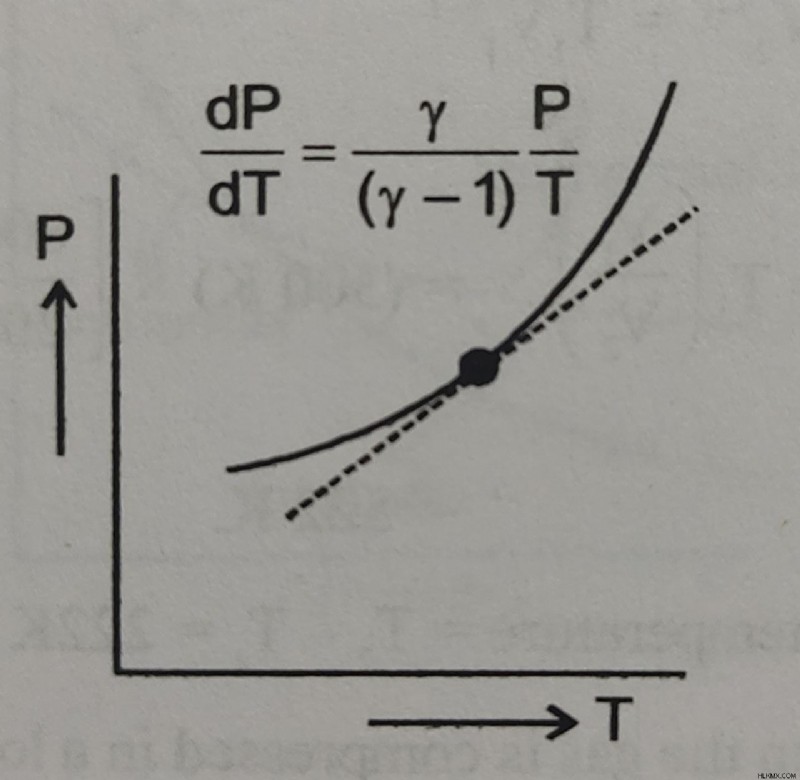
Κλίση της καμπύλης P-T σε αδιαβατική διαστολή :
Αφού T𝜸 P1 – 𝜸 =σταθερό
dV / dT =– 𝜸P / (1-𝜸)T =𝜸P / (𝜸-1)T
Εργασία που έγινε σε αδιαβατική διαδικασία:
△W =– △ U =nCv (Ti – Tf)
=Pi Vi – Pi Vi / ( 𝜸-1) =nR(Ti – Tf ) / 𝜸-1
Η εργασία που γίνεται από ένα σύστημα είναι (+ve) αν Ti> Tf (άρα λαμβάνει χώρα η επέκταση).
Η εργασία που γίνεται σε ένα σύστημα είναι (- ve) εάν Ti
Η αδιαβατική διαστολή είναι η θερμοδυναμική διαδικασία κατά την οποία η πίεση μειώνεται ή ο όγκος αυξάνεται όταν η θερμοκρασία είναι σταθερή. Η θερμική ισορροπία διατηρείται σε όλη τη διάρκεια της διαδικασίας. Αυτό το άρθρο καλύπτει θερμοδυναμικά συστήματα, διάφορους τύπους θερμοδυναμικών διεργασιών και τις ιδιαιτερότητες των διεργασιών ισοθερμικής διαστολής. Καλύπτεται επίσης η εργασία που εκτελείται κατά τη διάρκεια μιας διαδικασίας ισοθερμικής διαστολής.Συμπέρασμα




