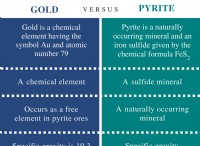
Είναι ιοντικές ενώσεις πολικές ή μη πολικές;
* Διαφορά ηλεκτροαρνητικότητας: Οι ιοντικοί δεσμοί σχηματίζονται μεταξύ στοιχείων με σημαντική διαφορά στην ηλεκτροαρνητικότητα. Αυτό σημαίνει ότι ένα άτομο (το πιο ηλεκτροαρνητικό) προσελκύει έντονα ηλεκτρόνια, ενώ το άλλο άτομο (το λιγότερο ηλεκτροαρνητικό) χάνει ηλεκτρόνια. Αυτό δημιουργεί ένα διαχωρισμό του φορτίου, με αποτέλεσμα μια διπολική στιγμή.
* Ανισορροπία χρέωσης: Τα άτομα σε μια ιοντική ένωση έχουν αντίθετες χρεώσεις. Το θετικό ιόν (κατιόν) και το αρνητικό ιόν (ανιόν) δημιουργούν ένα μόνιμο ηλεκτρικό δίπολο μέσα στην ένωση.
* Παράδειγμα: Το χλωριούχο νάτριο (NaCl) είναι ένα κλασικό παράδειγμα. Το χλώριο είναι πιο ηλεκτροαρνητικό από το νάτριο, οπότε προσελκύει τα κοινά ηλεκτρόνια πιο έντονα, με αποτέλεσμα ένα μερικό αρνητικό φορτίο στο χλώριο και ένα μερικό θετικό φορτίο στο νάτριο.
Ωστόσο, υπάρχουν κάποιες εξαιρέσεις:
* Συμμετρικές δομές: Εάν μια ιοντική ένωση έχει μια πολύ συμμετρική δομή, τα δίπολα μπορούν να ακυρώσουν ο ένας τον άλλον, οδηγώντας σε μη πολική ένωση. Για παράδειγμα, μια τέλεια κυβική δομή. Αυτό είναι λιγότερο συνηθισμένο.
Συμπερασματικά: Ενώ οι ιοντικές ενώσεις είναι γενικά πολικές, μπορεί να υπάρχουν εξαιρέσεις με βάση τη συγκεκριμένη δομή τους.