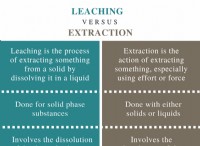
Τι έχει η υψηλότερη και η χαμηλότερη συγγένεια ηλεκτρονίων na mg al si p s cl ar;
Κατανόηση της συγγένειας ηλεκτρονίων
Η συγγένεια ηλεκτρονίων είναι η μεταβολή της ενέργειας όταν ένα ηλεκτρόνιο προστίθεται σε ένα ουδέτερο άτομο στην αέρια κατάσταση για να σχηματίσει ένα αρνητικό ιόν.
* Υψηλότερη συγγένεια ηλεκτρονίων σημαίνει ότι το άτομο έχει ισχυρότερη έλξη για ένα επιπλέον ηλεκτρόνιο.
* χαμηλότερη συγγένεια ηλεκτρονίων σημαίνει ότι το άτομο έχει μια ασθενέστερη έλξη για ένα επιπλέον ηλεκτρόνιο.
τάσεις στη συγγένεια ηλεκτρονίων
* Σε μια περίοδο (αριστερά προς τα δεξιά): Η συγγένεια ηλεκτρονίων γενικά αυξάνεται σε μια περίοδο, επειδή το αποτελεσματικό πυρηνικό φορτίο αυξάνεται, τραβώντας τα ηλεκτρόνια πιο έντονα.
* Κάτω από μια ομάδα (πάνω προς τα κάτω): Η συγγένεια των ηλεκτρονίων γενικά μειώνεται κάτω από μια ομάδα επειδή το εξώτατο ηλεκτρόνιο είναι περισσότερο από τον πυρήνα και θωρακισμένη από περισσότερα εσωτερικά ηλεκτρόνια, καθιστώντας το λιγότερο ελκυστικό.
Ανάλυση των στοιχείων:
* na (νάτριο): Χαμηλή συγγένεια ηλεκτρονίων. Είναι ένα αλκαλικό μέταλλο και χάνει εύκολα ηλεκτρόνια για να σχηματίσει ένα θετικό ιόν.
* mg (μαγνήσιο): Χαμηλότερη συγγένεια ηλεκτρονίων από το AL, αλλά υψηλότερη από το NA.
* al (αλουμίνιο): Υψηλότερη συγγένεια ηλεκτρονίων από τα Mg και Si.
* Si (πυριτίο): Υψηλότερη συγγένεια ηλεκτρονίων από το Ρ.
* p (φωσφόρος): Υψηλότερη συγγένεια ηλεκτρονίων από το S.
* S (θείο): Η υψηλότερη συγγένεια ηλεκτρονίων σε αυτήν την ομάδα. Έχει ένα σχετικά υψηλό αποτελεσματικό πυρηνικό φορτίο και μπορεί εύκολα να κερδίσει ηλεκτρόνια.
* cl (χλώριο): Υψηλή συγγένεια ηλεκτρονίων. Είναι ένα αλογόνο και κερδίζει εύκολα ένα ηλεκτρόνιο για να σχηματίσει ένα σταθερό ανιόν.
* AR (αργόν): Πολύ χαμηλή συγγένεια ηλεκτρονίων. Ως ευγενής αέριο, έχει ένα πλήρες εξωτερικό κέλυφος και δεν κερδίζει εύκολα ηλεκτρόνια.
Συμπέρασμα:
* Υψηλότερη συγγένεια ηλεκτρονίων: χλώριο (cl)
* χαμηλότερη συγγένεια ηλεκτρονίων: argon (ar)