Διαφορά μεταξύ ομοιοπολικού και συντεταγμένου δεσμού
Κύρια διαφορά – Ομοιοπολικός δεσμός έναντι δεσμού συντεταγμένων
Χημικός δεσμός είναι η σύνδεση δύο ατόμων μέσω ανταλλαγής ηλεκτρονίων. Αυτό μπορεί να γίνει είτε μέσω κοινής χρήσης ηλεκτρονίων είτε μέσω πλήρους απομάκρυνσης ηλεκτρονίων. Ένας χημικός δεσμός έχει πάντα ένα ζεύγος ηλεκτρονίων που έχουν αντίθετα σπιν. Αυτό το ζεύγος ηλεκτρονίων ονομάζεται ζεύγος δεσμών. Οι ομοιοπολικοί δεσμοί και οι δεσμοί συντεταγμένων είναι χημικοί δεσμοί που σχηματίζονται ως αποτέλεσμα της κοινής χρήσης ηλεκτρονίων μεταξύ δύο ατόμων. Ένας ομοιοπολικός δεσμός σχηματίζεται όταν και τα δύο άτομα μοιράζονται τα ηλεκτρόνια τους. Αλλά ένας δεσμός συντονισμού σχηματίζεται όταν ένα άτομο δωρίζει ένα από τα επιπλέον ζεύγη ηλεκτρονίων του σε ένα άλλο άτομο. Ωστόσο, μετά το σχηματισμό του δεσμού, τόσο ο ομοιοπολικός δεσμός όσο και ο δεσμός συντεταγμένων φαίνονται πανομοιότυποι. Η κύρια διαφορά μεταξύ ομοιοπολικού και συντεταγμένου δεσμού είναι ότι και τα δύο άτομα σε έναν ομοιοπολικό δεσμό συμβάλλουν στο σχηματισμό του δεσμού ενώ μόνο ένα άτομο σε έναν δεσμό συντονισμού συμβάλλει στο σχηματισμό του δεσμού.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ο ομοιοπολικός δεσμός
– Ορισμός, Σχηματισμός, Παραδείγματα
2. Τι είναι ο δεσμός συντεταγμένων
– Ορισμός, Σχηματισμός, Παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ ομοιοπολικού και συντεταγμένου δεσμού
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ ομοιοπολικού και συντεταγμένου δεσμού
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ζεύγος ομολόγων, δεσμός συντονισμού, ένωση συντονισμού, ομοιοπολικός δεσμός, μοναχικό ζεύγος, σθένος

Τι είναι ο ομοιοπολικός δεσμός
Ο ομοιοπολικός δεσμός είναι ένας τύπος χημικού δεσμού που σχηματίζεται όταν δύο άτομα μοιράζονται τα μη ζευγαρωμένα ηλεκτρόνια τους μεταξύ τους. Ένας ομοιοπολικός δεσμός μπορεί να σχηματιστεί μεταξύ δύο ατόμων του ίδιου στοιχείου ή διαφορετικών στοιχείων. Τις περισσότερες φορές, αυτοί οι ομοιοπολικοί δεσμοί βρίσκονται μεταξύ των μη μετάλλων. Δύο άτομα είναι πιο πιθανό να μοιράζονται ηλεκτρόνια όταν οι ηλεκτραρνητικότητες αυτών των ατόμων είναι περίπου παρόμοιες.
Τα άτομα τείνουν να μοιράζονται τα ηλεκτρόνια τους όταν υπάρχουν ασύζευκτα ηλεκτρόνια στα εξωτερικά τροχιακά τους. Μερικές φορές, τα άτομα μοιράζονται ηλεκτρόνια για να υπακούουν στον κανόνα της οκτάδας που υποδηλώνει σταθερότητα. Ωστόσο, αυτή η κοινή χρήση ηλεκτρονίων οδηγεί στο σχηματισμό νέων ενώσεων που αποτελούνται από άτομα σε διαφορετικούς συνδυασμούς. Ανάλογα με το σθένος ενός συγκεκριμένου ατόμου, ο αριθμός των ομοιοπολικών δεσμών που μπορεί να σχηματίσει μπορεί να ποικίλλει.
Ένας ομοιοπολικός δεσμός μπορεί να είναι είτε σίγμα είτε δεσμός pi. Ο δεσμός σίγμα είναι ένας απλός δεσμός, ο οποίος αποτελείται από ένα ζεύγος ηλεκτρονίων. Ένας διπλός δεσμός αποτελείται από έναν δεσμό σίγμα και έναν δεσμό pi. Και οι δύο δεσμοί είναι ομοιοπολικοί δεσμοί.
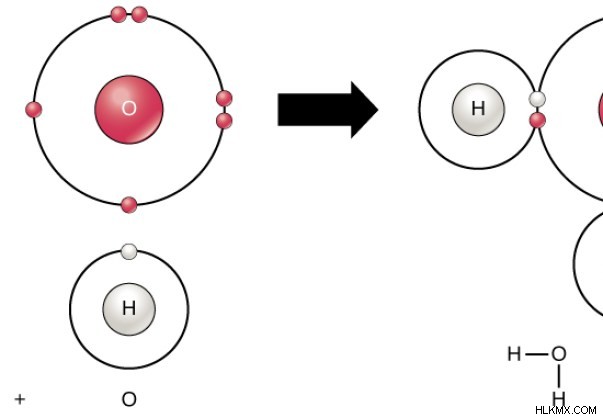
Εικόνα 1:Δομή του H2 O Μόριο
Για να σχηματιστεί ένας ομοιοπολικός δεσμός, και τα δύο άτομα θα πρέπει να συνεισφέρουν σε ίσες ποσότητες. Επομένως, ένα ηλεκτρόνιο από κάθε άτομο θα πρέπει να συμμετέχει για να σχηματιστεί ένας μόνο δεσμός. Για το σχηματισμό διπλού δεσμού, δίνονται δύο ηλεκτρόνια από κάθε άτομο.
Ένας ομοιοπολικός δεσμός μπορεί να είναι είτε πολικός είτε μη πολικός ανάλογα με την ηλεκτραρνητικότητα κάθε ατόμου. Εάν η διαφορά ηλεκτραρνητικότητας μεταξύ δύο ατόμων είναι πολύ χαμηλή (λιγότερη από 0,4) ή μηδέν, σχηματίζει έναν μη πολικό ομοιοπολικό δεσμό. Εάν η διαφορά στις ηλεκτραρνητικότητα δύο ατόμων είναι μεγαλύτερη (0,4-1,7), τότε πρόκειται για πολύ πολικό ομοιοπολικό δεσμό.
Τι είναι ο δεσμός συντεταγμένων
Ο δεσμός συντεταγμένων είναι ένας τύπος χημικού δεσμού που σχηματίζεται λόγω της δωρεάς ενός μοναχικού ζεύγους ηλεκτρονίων από ένα άτομο σε άλλο άτομο. Εδώ, το μοναχικό ζεύγος ηλεκτρονίων μοιράζεται από δύο άτομα. Αυτό συμβαίνει μεταξύ ενός ατόμου που είναι πλούσιο σε ηλεκτρόνια και ενός ατόμου που έχει ανεπάρκεια σε ηλεκτρόνια. Το πλούσιο σε ηλεκτρόνια άτομο θα δώσει ένα ζεύγος ηλεκτρονίων στο άτομο με έλλειψη ηλεκτρονίων. Ωστόσο, μετά το σχηματισμό του δεσμού συντεταγμένων, φαίνεται πανομοιότυπος με έναν ομοιοπολικό δεσμό.
Για να σχηματιστεί ένας δεσμός συντεταγμένων, το είδος με έλλειψη ηλεκτρονίων θα πρέπει να έχει κενά τροχιακά για το εισερχόμενο ζεύγος ηλεκτρονίων. Για παράδειγμα, στο BF3 μόριο, το Βόριο (Β) έχει ένα κενό τροχιακό p. Δεδομένου ότι η διαμόρφωση ηλεκτρονίων του Β δεν υπακούει στον κανόνα της οκτάδας, σχηματίζει έναν δεσμό συντεταγμένων με ένα είδος πλούσιο σε ηλεκτρόνια όπως το NH3 . Εκεί, το άτομο αζώτου έχει ένα μόνο ζεύγος ηλεκτρονίων που μπορεί να δοθεί στο άτομο Β του BF3 . Μετά το σχηματισμό αυτού του δεσμού συντεταγμένων, όλοι οι δεσμοί σε ολόκληρο το μόριο φαίνονται παρόμοιοι.

Εικόνα 2:Συντεταγμένος δεσμός μεταξύ NH3 και BF3
Τα ιόντα μετάλλων μπορούν να σχηματίσουν δεσμούς συντεταγμένων με είδη πλούσια σε ηλεκτρόνια που ονομάζονται συνδέτες. Δεδομένου ότι τα μεταλλικά ιόντα είναι θετικά φορτισμένα άτομα, οι συνδέτες μπορούν να δωρίσουν ζεύγη ηλεκτρονίων στο άτομο μετάλλου. Δεδομένου ότι τα περισσότερα από τα άτομα μετάλλων έχουν κενά d τροχιακά, τα εισερχόμενα ζεύγη ηλεκτρονίων μπορούν να ενσωματωθούν σε αυτά τα κενά d τροχιακά. Αυτά τα σύμπλοκα μετάλλου-προσδέματος ονομάζονται σύμπλοκα συντονισμού.
Ομοιότητες μεταξύ ομοιοπολικού και συντεταγμένου δεσμού
- Μετά τον σχηματισμό ομοιοπολικών και συντεταγμένων δεσμών, και οι δύο τύποι δεσμών φαίνονται ίδιοι.
- Και οι δύο τύποι δεσμών αποτελούνται από ένα ζεύγος ηλεκτρονίων ανά κάθε δεσμό.
- Και οι δύο τύποι δεσμών προκαλούν τη σύνδεση δύο ατόμων μεταξύ τους.
Διαφορά μεταξύ ομοιοπολικού και συντεταγμένου δεσμού
Ορισμός
Ομοιοπολικός δεσμός: Ο ομοιοπολικός δεσμός είναι ένας τύπος χημικού δεσμού που σχηματίζεται όταν δύο άτομα μοιράζονται τα μη ζευγαρωμένα ηλεκτρόνια μεταξύ τους.
Δεσμός Συντεταγμένων: Ο δεσμός συντεταγμένων είναι ένας τύπος χημικού δεσμού που σχηματίζεται λόγω της δωρεάς ενός μοναχικού ζεύγους ηλεκτρονίων από ένα άτομο σε άλλο άτομο.
Δωρεά ηλεκτρονίων
Ομοιοπολικός δεσμός: Δύο άτομα δίνουν ίσο αριθμό ηλεκτρονίων για το σχηματισμό του δεσμού.
Δεσμός Συντεταγμένων: Μόνο ένα άτομο δίνει ένα ζεύγος ηλεκτρονίων για το σχηματισμό του δεσμού.
Παρουσία μη συζευγμένων ηλεκτρονίων
Ομοιοπολικός δεσμός: Θα πρέπει να υπάρχουν ασύζευκτα ηλεκτρόνια για να σχηματιστεί ένας ομοιοπολικός δεσμός.
Δεσμός Συντεταγμένων: Δεν πρέπει να υπάρχουν ασύζευκτα ηλεκτρόνια για να σχηματιστεί ένας δεσμός συντεταγμένων.
Παρουσία κενών τροχιακών
Ομοιοπολικός δεσμός: Για να σχηματιστεί ένας ομοιοπολικός δεσμός, δεν απαιτούνται κενά τροχιακά.
Δεσμός Συντεταγμένων: Θα πρέπει να υπάρχουν κενά τροχιακά στα είδη με έλλειψη ηλεκτρονίων προκειμένου να σχηματιστούν δεσμοί συντεταγμένων.
Παρουσία μοναχικού ζεύγους
Ομοιοπολικός δεσμός: Για να σχηματιστεί ένας ομοιοπολικός δεσμός, δεν απαιτούνται μεμονωμένα ζεύγη ηλεκτρονίων.
Δεσμός Συντεταγμένων: Για να σχηματιστεί ένας δεσμός συντεταγμένων, θα πρέπει να υπάρχει τουλάχιστον ένα μεμονωμένο ζεύγος ηλεκτρονίων σε ένα από τα δύο άτομα.
Πολικότητα του δεσμού
Ομοιοπολικός δεσμός: Οι ομοιοπολικοί δεσμοί μπορεί να είναι είτε πολικοί είτε μη πολικοί ανάλογα με τη διαφορά στις ηλεκτραρνητικότητες δύο ατόμων.
Δεσμός Συντεταγμένων: Οι δεσμοί συντεταγμένων είναι πολικοί δεσμοί.
Συμπέρασμα
Τόσο ο ομοιοπολικός δεσμός όσο και ο δεσμός συντεταγμένων είναι τύποι χημικών δεσμών. Βοηθούν στο να συγκρατούν τα άτομα μαζί για να σχηματίσουν ενώσεις. Μετά το σχηματισμό αυτών των δεσμών, τόσο ο ομοιοπολικός δεσμός όσο και ο δεσμός συντεταγμένων φαίνεται να είναι πανομοιότυποι. Δεν είναι όμως το ίδιο. Υπάρχει μια σαφής διαφορά μεταξύ ομοιοπολικού και συντεταγμένου δεσμού. σε έναν ομοιοπολικό δεσμό, και τα δύο άτομα εμπλέκονται στο σχηματισμό του δεσμού ενώ, στον δεσμό συντονισμού, μόνο ένα άτομο εμπλέκεται στο σχηματισμό του δεσμού.




