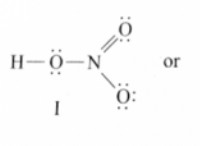
Ποια είναι η πλήρης ισορροπημένη εξίσωση θειικού χαλκού με αμμωνία;
Στάδια αντίδρασης:
1. Σχηματισμός ενός ίζημα: Όταν η αμμωνία προστίθεται αρχικά σε ένα διάλυμα θειικού χαλκού, σχηματίζεται ένα γαλάζιο ίζημα του υδροξειδίου του χαλκού (Cu (OH) ₂):
(Aq) + 2nh₃ (aq) + 2H₂O (l) → cu (oh) ₂ (s) + (nh₄) ₂so₄ (aq)
2. Διάλυση του ίζημα: Καθώς προστίθεται περισσότερη αμμωνία, το ίζημα του υδροξειδίου του χαλκού διαλύεται, σχηματίζοντας ένα βαθύ μπλε διάλυμα που περιέχει ιόντα τετρααμαμινέπερ (II):
Cu (OH) ₂ (s) + 4nh₃ (aq) → [Cu (NH₃) ₄] ²⁺ (aq) + 2OH⁻ (aq)
Συνολική ισορροπημένη εξίσωση:
Συνδυάζοντας και τα δύο στάδια, η πλήρης ισορροπημένη εξίσωση για την αντίδραση θειικού χαλκού με υπερβολική αμμωνία είναι:
cuso₄ (aq) + 4nH₃ (aq) + 2H₂O (l) → [cu (nh₃) ₄] ² (aq) + so₄2⁻ (aq) + 2OH⁻ (aq)
Βασικά σημεία:
* Το βαθύ μπλε χρώμα του διαλύματος είναι χαρακτηριστικό του ιόντος TetraammineCopper (II), [Cu (NH₃) ₄] ².
* Η αντίδραση είναι αναστρέψιμη, πράγμα που σημαίνει ότι η προσθήκη ενός οξέος μπορεί να μετατοπίσει τα προσδέματα αμμωνίας, προκαλώντας τη μεταρρύθμιση του ίζημα.
Αυτή η αντίδραση είναι ένα κλασικό παράδειγμα του τρόπου με τον οποίο τα σύμπλοκα συντονισμού μπορούν να σχηματιστούν μέσω της αντίδρασης μεταλλικών ιόντων με προσδέματα.