Πώς δημιουργούν τα άτομα ένα δεσμό;
Ακολουθεί μια κατανομή των διαφόρων τύπων χημικών δεσμών:
1. Ομοιοπολικοί δεσμοί:
* Κοινή χρήση ηλεκτρονίων: Τα άτομα μοιράζονται τα ηλεκτρόνια σθένους για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων.
* μη μέταλλο-nonmetal: Τυπικά σχηματίζονται μεταξύ δύο μη μεταλλικών.
* Ισχυρά ομόλογα: Αυτοί οι δεσμοί συγκρατούν σφιχτά τα άτομα, με αποτέλεσμα σταθερά μόρια.
* Παραδείγματα: Νερό (H₂O), μεθάνιο (CH₄), διοξείδιο του άνθρακα (CO₂)
2. Ιωνικοί δεσμοί:
* Μεταφορά ηλεκτρονίων: Ένα άτομο χάνει ένα ηλεκτρόνιο (που γίνεται θετικά φορτισμένο κατιόν) ενώ ο άλλος κερδίζει ένα ηλεκτρόνιο (καθιστώντας αρνητικά φορτισμένο ανιόν).
* metal-nonmetal: Συνήθως σχηματίζεται μεταξύ ενός μετάλλου και ενός μη μέταλλου.
* Ηλεκτροστατική έλξη: Τα αντίθετα φορτισμένα ιόντα προσελκύουν ο ένας τον άλλον έντονα, σχηματίζοντας μια σταθερή ιοντική ένωση.
* Παραδείγματα: Χλωριούχο νάτριο (NaCl), βρωμιούχο κάλιο (KBR), οξείδιο του ασβεστίου (CAO)
3. Μεταλλικοί δεσμοί:
* Electron Sea Model: Τα ηλεκτρόνια σθένους απομακρύνονται και μπορούν να κινούνται ελεύθερα σε όλο το μεταλλικό πλέγμα.
* Metal-Metal: Βρέθηκε σε μεταλλικά στοιχεία.
* Ισχυρά ομόλογα: Συμβάλλουν στις μοναδικές ιδιότητες των μετάλλων, όπως η αγωγιμότητα και η ευελιξία.
* Παραδείγματα: Χρυσός (AU), Χαλκός (Cu), Σίδηρος (Fe)
4. Δεσμοί υδρογόνου:
* Ειδικός τύπος αλληλεπίδρασης διπόλης-διπόλης: Ένα άτομο υδρογόνου που συνδέεται με ένα πολύ ηλεκτροαρνητικό άτομο (όπως το οξυγόνο ή το άζωτο) προσελκύεται από ένα μοναδικό ζεύγος ηλεκτρονίων σε ένα άλλο ηλεκτροαρνητικό άτομο.
* αδύναμοι δεσμοί: Σχετικά αδύναμη σε σύγκριση με ομοιοπολικούς ή ιοντικούς δεσμούς, αλλά διαδραματίζουν σημαντικούς ρόλους σε βιολογικά συστήματα και ιδιότητες νερού.
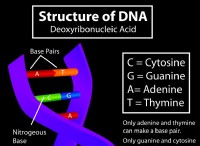
* Παραδείγματα: Μόρια νερού, δομή DNA, αναδίπλωση πρωτεΐνης
Παράγοντες που επηρεάζουν τον σχηματισμό ομολόγων:
* Ηλεκτροργατιστικότητα: Η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια.
* Επίπεδα ενέργειας: Τα άτομα τείνουν να σχηματίζουν δεσμούς που μειώνουν τη συνολική τους ενέργεια.
* Κανόνας οκτάδων: Πολλά άτομα προσπαθούν να έχουν οκτώ ηλεκτρόνια στο εξωτερικό τους κέλυφος.
Η κατανόηση του τρόπου με τον οποίο ο δεσμός των ατόμων είναι θεμελιώδης για την κατανόηση της δομής και της συμπεριφοράς των μορίων, των ενώσεων και των υλικών.