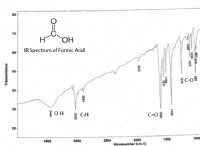
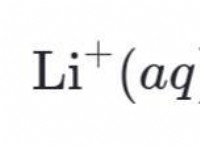Είναι SO3 ιοντικός ή ομοιοπολικός δεσμός;
* Ηλεκτροργατιστικότητα: Το οξυγόνο είναι πολύ πιο ηλεκτροαρνητικό από το θείο. Αυτό σημαίνει ότι το οξυγόνο έχει ισχυρότερη έλξη σε κοινά ηλεκτρόνια στο δεσμό.
* μη μέταλλο-nonmetal: Τόσο το θείο όσο και το οξυγόνο είναι μη μέταλλα. Τα μη μέταλλα γενικά σχηματίζουν ομοιοπολικούς δεσμούς με την κοινή χρήση ηλεκτρονίων.
* Polar Covalent: Ενώ οι δεσμοί είναι ομοιοπολικοί, η σημαντική διαφορά ηλεκτροαρνητικότητας μεταξύ θείου και οξυγόνου καθιστά τους δεσμούς πολικούς. Αυτό σημαίνει ότι υπάρχει ένα μερικό αρνητικό φορτίο στα άτομα οξυγόνου και ένα μερικό θετικό φορτίο στο άτομο θείου.
Συνοπτικά, οι δεσμοί στο SO3 είναι ομοιοπολικοί επειδή σχηματίζονται μεταξύ δύο μη μεταλλικών και είναι πολικές λόγω της διαφοράς στην ηλεκτροαρνητικότητα.