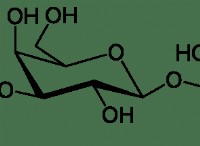
Ποιες δομικές μονάδες αποτελούν ιονικά στερεά;
* ΚΟΟΔΙΑ: Θετικά φορτισμένα ιόντα.
* Anions: Αρνητικά φορτισμένα ιόντα.
Η διάταξη αυτών των ιόντων στο πλέγμα καθορίζεται από:
* Τα σχετικά μεγέθη των ιόντων: Τα μικρότερα ιόντα μπορούν να χωρέσουν πιο κοντά σε μεγαλύτερα ιόντα, επηρεάζοντας τη συνολική δομή.
* Ο λόγος των φορτίων των ιόντων: Η αντοχή της ηλεκτροστατικής έλξης εξαρτάται από τις χρεώσεις.
Ακολουθεί μια ανάλυση των διαρθρωτικών μονάδων:
* Κύτταρο μονάδας: Η μικρότερη επαναλαμβανόμενη μονάδα του κρυσταλλικού πλέγματος. Περιέχει τη θεμελιώδη διάταξη των ιόντων που καθορίζει ολόκληρη τη δομή.
* ιόντα: Μεμονωμένα άτομα ή ομάδες ατόμων που έχουν κερδίσει ή χαμένα ηλεκτρόνια, φέρνοντας καθαρό θετικό ή αρνητικό φορτίο.
* ηλεκτροστατικές δυνάμεις: Οι ελκυστικές δυνάμεις που κρατούν τα ιόντα μαζί στο πλέγμα. Αυτές οι δυνάμεις είναι ισχυρές και υπεύθυνες για τις χαρακτηριστικές ιδιότητες των ιοντικών στερεών όπως το υψηλό σημείο τήξης, τη σκληρότητα και την ευγένεια.
Παραδείγματα:
* Χλωριούχο νάτριο (NaCl): Περιέχει κατιόντα Na+ και Cl-Anions που είναι διατεταγμένα σε κυβικό πλέγμα.
* φθοριούχο ασβέστιο (CAF2): Περιέχει κατιόντα Ca2+ και f-inions που είναι διατεταγμένα σε ένα πλέγμα με επίκεντρο το πρόσωπο.
Συνοπτικά, τα ιοντικά στερεά είναι κατασκευασμένα από κρυστάλλινα πλέγματα Αποτελείται από κατιόντα και ανιόντα που συγκρατούνται από ισχυρές ηλεκτροστατικές δυνάμεις . Η διάταξη αυτών των ιόντων στο πλέγμα ορίζει το μονάδα κυψέλης και τη συνολική δομή του ιοντικού στερεού.