Είναι το NOCL ένα πολικό ή μη πολικό μόριο;
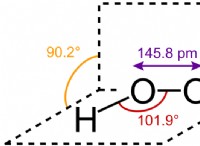
* Μοριακή γεωμετρία: Το NOCL έχει λυγισμένο ή γωνιακό σχήμα. Το κεντρικό άτομο αζώτου συνδέεται με ένα άτομο οξυγόνου και ένα άτομο χλωρίου.
* Ηλεκτροργατιστικότητα: Το οξυγόνο είναι περισσότερο ηλεκτροαρνητικό από το άζωτο και το χλώριο είναι επίσης πιο ηλεκτροαρνητικό από το άζωτο. Αυτό σημαίνει ότι τα ζεύγη ηλεκτρονίων στους δεσμούς Ν-Ο και Ν-CR τραβούν περισσότερο προς τα άτομα οξυγόνου και χλωρίου, αντίστοιχα.
* Διπολική στιγμή: Λόγω της άνισης κατανομής των ηλεκτρονίων, αναπτύσσεται ένα μερικό αρνητικό φορτίο στα άτομα οξυγόνου και χλωρίου και αναπτύσσεται ένα μερικό θετικό φορτίο στο άτομο αζώτου. Αυτό δημιουργεί μια μόνιμη διπολική στιγμή στο μόριο, καθιστώντας το πολικό.
Συνοπτικά: Το λυγισμένο σχήμα και η διαφορά στην ηλεκτροαρνητικότητα μεταξύ των ατόμων οδηγούν σε ανομοιογενή κατανομή της πυκνότητας ηλεκτρονίων, με αποτέλεσμα μια καθαρή διπολική στιγμή για το μόριο NOCL.