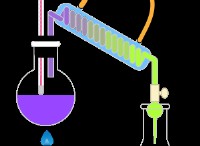
Πώς κρύσταλλοι χλωριούχου ασβεστίου από ανθρακικό και αραιωμένο υδροχλωρικό οξύ;
Υλικά:
* Ανθρακικό ασβέστιο (caco₃)
* Αραιώστε υδροχλωρικό οξύ (HCl) - συνήθως περίπου 5-10% συγκέντρωση
* Ποτήρι ή φιάλη
* Ανάδευση ή μαγνητικό αναδευτήρα
* Διηθητικό χαρτί
* Χωνιά
* Εξατμίζοντας πιάτο
* Bunsen Burner ή Hot Plate
* Παρακολουθήστε γυαλί ή κάλυμμα
* Γυαλιά ασφαλείας
* Γάντια
Διαδικασία:
1. Ασφάλεια πρώτα: Φορέστε γυαλιά και γάντια ασφαλείας σε όλο το πείραμα. Εργαστείτε σε μια καλά αεριζόμενη περιοχή.
2. Αντίδραση:
* Τοποθετήστε μια μικρή ποσότητα ανθρακικού ασβεστίου στο ποτήρι.
* Προσθέστε αργά αραιό υδροχλωρικό οξύ στο ποτήρι, ανακατεύοντας συνεχώς. Αυτό θα προκαλέσει μια αντίδραση που απελευθερώνεται καθώς απελευθερώνεται αέριο διοξειδίου του άνθρακα.
* Η εξίσωση αντίδρασης είναι:
Caco₃ (s) + 2HCl (aq) → caCl₂ (aq) + co₂ (g) + h₂o (l)
3. Φιλτράρισμα:
* Μόλις υποχωρήσει η εξάλειψη, θα έχετε μια λύση χλωριούχου ασβεστίου (CaCl₂) στο νερό.
* Φιλτράρετε προσεκτικά το διάλυμα χρησιμοποιώντας το χαρτί φίλτρου και τη διοχέτευση για να αφαιρέσετε τυχόν αδιευκρίνιστο ανθρακικό ασβέστιο.
4. Εξάτμιση:
* Ρίξτε το φιλτραρισμένο διάλυμα χλωριούχου ασβεστίου στο πιάτο εξάτμισης.
* Ζεσταίνετε απαλά το διάλυμα χρησιμοποιώντας έναν καυστήρα Bunsen ή μια καυτή πλάκα. Αυτό θα εξατμίσει το νερό, αφήνοντας πίσω τους κρυστάλλους χλωριούχου ασβεστίου.
* ΣΗΜΑΝΤΙΚΟ: Μην βράζετε το διάλυμα ξηρό, καθώς αυτό μπορεί να οδηγήσει στον σχηματισμό άνυδρου χλωριούχου ασβεστίου, το οποίο είναι πολύ υγροσκοπικό (απορροφά την υγρασία από τον αέρα).
5. Κρυστάλλωση:
* Καθώς το νερό εξατμίζεται, το διάλυμα χλωριούχου ασβεστίου θα γίνει πιο συγκεντρωμένο και οι κρύσταλλοι θα αρχίσουν να σχηματίζονται.
* Αφήστε τη λύση να κρυώσει αργά, η οποία θα βοηθήσει τους μεγαλύτερους κρυστάλλους.
6. Συγκομιδή:
* Μόλις η λύση έχει κρυώσει πλήρως, μπορείτε να αποσυνδεθείτε προσεκτικά το υπόλοιπο υγρό (εάν υπάρχει).
* Οι κρύσταλλοι χλωριούχου ασβεστίου θα παραμείνουν στο πιάτο εξατμίσεων.
* Μπορείτε να στεγνώσετε τους κρυστάλλους περαιτέρω με την απαλή θέρμανση τους σε ένα φούρνο ή επιτρέποντάς τους να στεγνώσουν αέρα.
Σημαντικές σημειώσεις:
* Συγκέντρωση: Η συγκέντρωση του χρησιμοποιούμενου υδροχλωρικού οξέος θα επηρεάσει την ταχύτητα της αντίδρασης και το μέγεθος των κρυστάλλων. Ένα πιο αραιό οξύ θα οδηγήσει σε βραδύτερη αντίδραση και μικρότερους κρυστάλλους.
* εξάτμιση: Προσέξτε να μην θερμαίνετε το διάλυμα πολύ γρήγορα, καθώς αυτό μπορεί να προκαλέσει σπασμό.
* Μέγεθος κρυστάλλου: Ο ρυθμός ψύξης και η συγκέντρωση του διαλύματος θα επηρεάσουν το μέγεθος των κρυστάλλων. Η βραδύτερη ψύξη και τα πιο συγκεντρωμένα διαλύματα τείνουν να παράγουν μεγαλύτερους κρυστάλλους.
Προφυλάξεις ασφαλείας:
* Το υδροχλωρικό οξύ είναι διαβρωτικό. Αποφύγετε την επαφή με το δέρμα ή τα μάτια.
* Εργαστείτε σε μια καλά αεριζόμενη περιοχή για να αποτρέψετε την εισπνοή καπνών.
* Απορρίψτε σωστά τις χημικές ουσίες.
Επιτρέψτε μου να ξέρω αν έχετε περισσότερες ερωτήσεις!