Διαφορά μεταξύ πρωτίου δευτερίου και τριτίου
Κύρια διαφορά – Protium vs Deuterium vs Tritium
Το πρωτείο, το δευτέριο και το τρίτιο είναι ισότοπα του στοιχείου Υδρογόνου. Τα ισότοπα είναι διαφορετικές μορφές του ίδιου στοιχείου που διαφέρουν μεταξύ τους ανάλογα με τον αριθμό των νετρονίων που έχουν στους πυρήνες τους. Επομένως, τα ισότοπα έχουν τον ίδιο ατομικό αριθμό αλλά διαφορετικές ατομικές μάζες. Για το λόγο αυτό, τα ισότοπα έχουν διαφορετικές φυσικές ιδιότητες αλλά οι χημικές ιδιότητες παραμένουν ίδιες επειδή ο αριθμός των ηλεκτρονίων που υπάρχουν στα ισότοπα είναι ίσος. Επομένως, το Protium, το Deuterium και το Tritium μοιράζονται ορισμένες ομοιότητες καθώς και διαφορές. Η κύρια διαφορά μεταξύ του Πρωτίου Δευτέριου και του Τριτίου είναι ότι το Πρώτιο δεν έχει νετρόνια στους πυρήνες του, ενώ το δευτέριο αποτελείται από ένα νετρόνιο και το τρίτιο από δύο νετρόνια.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Protium
– Ορισμός, ιδιότητες και αφθονία
2. Τι είναι το Δευτέριο
– Ορισμός, ιδιότητες και αφθονία
3. Τι είναι το τρίτιο
– Ορισμός, ιδιότητες και αφθονία
4. Ποιες είναι οι ομοιότητες μεταξύ του πρωτίου δευτερίου και του τριτίου
– Περίληψη κοινών χαρακτηριστικών
5. Ποια είναι η διαφορά μεταξύ πρωτίου δευτερίου και τριτίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ατομική μάζα, ατομικός αριθμός, δευτέριο, ισότοπα, νετρόνιο, πρωτείο, τρίτιο 
Τι είναι το Protium
Το πρωτίου είναι ένα ισότοπο του Υδρογόνου που αποτελείται από ένα πρωτόνιο και ένα ηλεκτρόνιο. Είναι η πιο άφθονη μορφή υδρογόνου. Η αφθονία αυτού του ισοτόπου στον φλοιό της γης είναι περίπου 99,9%. Το Protium δεν έχει νετρόνια στον πυρήνα του. Θεωρείται ως το πιο σταθερό ισότοπο υδρογόνου. Επομένως, όταν μιλάμε συνήθως για υδρογόνο, μιλάμε για Protium.
Ο ατομικός αριθμός του Protium είναι 1 λόγω της παρουσίας ενός πρωτονίου. Ο μαζικός αριθμός του Protium είναι επίσης 1 αφού δεν υπάρχουν νετρόνια στον πυρήνα του Protium. Η ατομική μάζα του Protium είναι περίπου 1,00794 amu. Το σύμβολο για το Protium είναι H. Η διαμόρφωση ηλεκτρονίων του Protium είναι 1s.
Το πρωτίιο μπορεί να βρεθεί στη φύση ως διατομική αέρια μορφή ή ως υδρογόνο στο H2 Ω μόριο. Ο δεσμός μεταξύ δύο ατόμων στο διατομικό μόριο έχει υψηλότερη ενθαλπία διάστασης δεσμού. Αυτό συμβαίνει κυρίως επειδή αυτά τα άτομα είναι λεπτά και έχουν πλήρεις διαμορφώσεις ηλεκτρονίων στο μόνο τροχιακό (s τροχιακό) στη διατομική μοριακή τους μορφή.
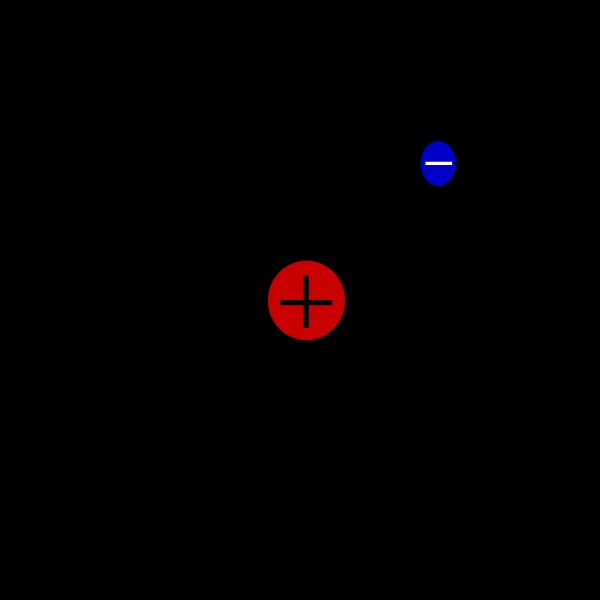
Εικόνα 1:Ατομική Δομή Πρωτίου
Η παραπάνω εικόνα δείχνει την ατομική δομή του Protium. Εδώ, το πρωτόνιο εμφανίζεται στο κέντρο του ατόμου (πυρήνας) και το ηλεκτρόνιο εμφανίζεται έξω από τον πυρήνα με μπλε χρώμα.
Τι είναι το Δευτέριο
Το δευτέριο είναι ένα ισότοπο του Υδρογόνου που αποτελείται από ένα πρωτόνιο, ένα νετρόνιο και ένα ηλεκτρόνιο. Ο πυρήνας του Δευτερίου αποτελείται από ένα πρωτόνιο και ένα νετρόνιο. Το σύμβολο για το Δευτέριο δίνεται ως H. Ο ατομικός αριθμός του δευτερίου είναι 1 και ο μαζικός αριθμός είναι 2. Η ατομική μάζα μπορεί να δοθεί ως 2,014 amu. Αυτό είναι επίσης ένα σταθερό ισότοπο υδρογόνου αλλά είναι λιγότερο άφθονο. Η αφθονία του Δευτερίου στον φλοιό της γης έχει υπολογιστεί ως 0,015%. Δεν είναι ραδιενεργό αφού το Δευτέριο είναι σταθερό με ένα πρωτόνιο και ένα νετρόνιο στον πυρήνα του.
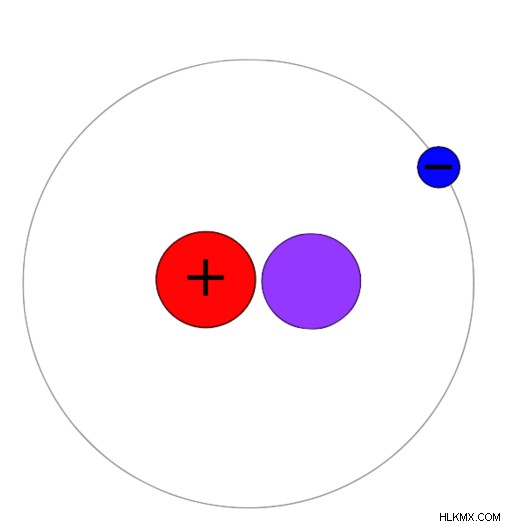
Εικόνα 2:Ατομική Δομή του Δευτερίου
Η εμφάνιση του δευτερίου μπορεί να είναι είτε σε αέρια είτε σε υγρή φάση. Το δευτέριο υπάρχει ως διατομικά αέρια όπως το D2 ή HD (σε συνδυασμό με υδρογόνο). Εάν όχι, το Δευτέριο μπορεί να βρεθεί ως βαρύ νερό. Το βαρύ νερό αποτελείται από D2 Ω μόρια. Τις περισσότερες φορές, το Δευτέριο ενεργεί με παρόμοιο τρόπο όπως το Protium. Υπάρχουν όμως και ορισμένες διαφορές. Λόγω της παρουσίας του νετρονίου, η ατομική μάζα του δευτερίου είναι διπλάσια από το Πρωτίου. Επομένως, το μήκος του δεσμού και η ενέργεια του δεσμού είναι διαφορετικά από αυτά του Protium. Επιπλέον, ο πάγος που δημιουργείται από βαρύ νερό θα βυθιστεί σε υγρό νερό λόγω της υψηλής πυκνότητας (ο κανονικός πάγος επιπλέει στην επιφάνεια του υγρού νερού).
Υπάρχουν επίσης ορισμένες εφαρμογές του Deuterium. Στη φασματοσκοπία NMR, οι ενώσεις που περιλαμβάνονται στο Δευτέριο χρησιμοποιούνται ως διαλύτης αντί για ενώσεις που αποτελούνται από Υδρογόνο. Στη συνέχεια, οι κορυφές που δίνονται από τα άτομα υδρογόνου της αναλυόμενης ουσίας μπορούν να διακριθούν από τα άτομα του διαλύτη.
Τι είναι το Tritium
Το τρίτιο είναι ένα ισότοπο υδρογόνου που αποτελείται από ένα πρωτόνιο, δύο νετρόνια και ένα ηλεκτρόνιο. Το σύμβολο για το τρίτιο είναι Η. Ο ατομικός αριθμός του τριτίου είναι 1 και η ατομική μάζα του τριτίου είναι 3. Η μάζα μπορεί να δοθεί ως 3,016 amu. Αυτό το ισότοπο υδρογόνου είναι ραδιενεργό λόγω της παρουσίας μεγάλου αριθμού νετρονίων σε σύγκριση με τον αριθμό των πρωτονίων.
Το τρίτιο συχνά υφίσταται διάσπαση βήτα. Αυτό παράγει το Helim-3 και απελευθερώνει μεγάλη ποσότητα ενέργειας. Ο χρόνος ημιζωής του Τριτίου έχει υπολογιστεί ως 12,32 έτη. Ωστόσο, η αφθονία του Τριτίου στον φλοιό της γης είναι πολύ μικρότερη.
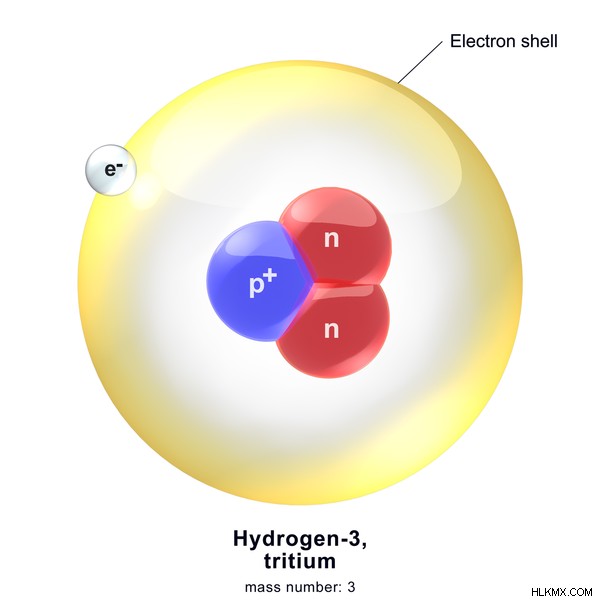
Εικόνα 3:Ατομική Δομή Τριτίου
Η παραπάνω εικόνα δείχνει την ατομική δομή του Τριτίου. Ο μαζικός αριθμός του Τριτίου είναι 3 λόγω της παρουσίας δύο νετρονίων (σε κόκκινο χρώμα) και ενός πρωτονίου (σε μπλε χρώμα).
Ομοιότητες μεταξύ πρωτίου δευτερίου και τριτίου
- Το πρωτείο, το δευτέριο και το τρίτιο είναι ισότοπα υδρογόνου.
- Αυτά τα ισότοπα αποτελούνται από 1 πρωτόνιο ανά πυρήνα.
- Και τα τρία αποτελούνται από 1 ηλεκτρόνιο.
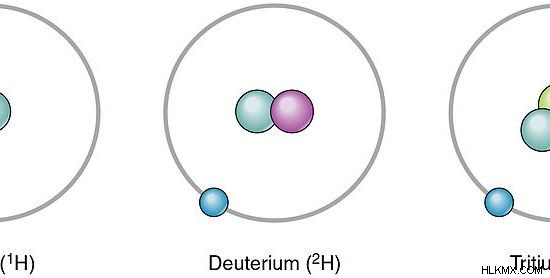
Εικόνα 4:Πρωτίου δευτέριο τρίτιο
Διαφορά μεταξύ πρωτίου δευτερίου και τριτίου
Ορισμός
Protium: Το Protium είναι ένα ισότοπο του Υδρογόνου που αποτελείται από ένα πρωτόνιο και ένα ηλεκτρόνιο.
Δευτέριο: Το δευτέριο είναι ένα ισότοπο του Υδρογόνου που αποτελείται από ένα πρωτόνιο, ένα νετρόνιο και ένα ηλεκτρόνιο.
Τρίτιο: Το τρίτιο είναι ένα ισότοπο υδρογόνου που αποτελείται από ένα πρωτόνιο, δύο νετρόνια και ένα ηλεκτρόνιο.
Αφθονία
Protium: Η αφθονία του Protium είναι περίπου 99,9%.
Δευτέριο: Η αφθονία του Δευτερίου είναι περίπου 0,015%.
Τρίτιο: Το τρίτιο βρίσκεται σε πολύ ίχνη.
Χημικό σύμβολο
Protium: Το σύμβολο για το Protium είναι H.
Δευτέριο: Το σύμβολο για το Δευτέριο είναι H.
Τρίτιο: Το σύμβολο για το τρίτιο είναι H.
Μαζικός αριθμός
Protium: Ο μαζικός αριθμός του Protium είναι 1.
Δευτέριο: Ο μαζικός αριθμός του δευτερίου είναι 2.
Τρίτιο: Ο μαζικός αριθμός του Τριτίου είναι 3.
Ατομική μάζα
Protium: Η ατομική μάζα του Protium είναι 1,00794 amu.
Δευτέριο: Η ατομική μάζα του δευτερίου είναι 2,014 amu.
Τρίτιο: Η ατομική μάζα του Τριτίου είναι 3,016 amu.
Ραδιενέργεια
Protium: Το Protium δεν είναι ραδιενεργό.
Δευτέριο: Το δευτέριο δεν είναι ραδιενεργό.
Τρίτιο: Το τρίτιο είναι ραδιενεργό.
Συμπέρασμα
Το πρωτίου, το δευτέριο και το τρίτιο είναι τρία ισότοπα υδρογόνου. Εκτός από αυτά τα ισότοπα, μπορεί να υπάρχουν και κάποιες άλλες μορφές υδρογόνου. Αλλά είναι εξαιρετικά ασταθή λόγω της παρουσίας μεγάλου αριθμού νετρονίων. Η κύρια διαφορά μεταξύ του πρωτίου δευτέριου και του τριτίου είναι ότι το Πρωτίου δεν έχει νετρόνια στους πυρήνες του, ενώ το δευτέριο αποτελείται από ένα νετρόνιο και το τρίτιο από δύο νετρόνια.




