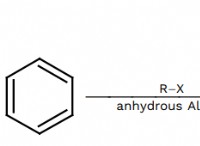
Ποιο είναι το υψηλότερο σημείο βρασμού Ne N2 O2 CL2 SIH4;
Κατανόηση του σημείου βρασμού
Το σημείο βρασμού είναι η θερμοκρασία στην οποία μια ουσία μεταβαίνει από υγρό σε αέριο. Όσο ισχυρότερες είναι οι διαμοριακές δυνάμεις (ΔΝΤ) μεταξύ των μορίων, τόσο περισσότερη ενέργεια απαιτείται για να ξεπεραστούν αυτές οι δυνάμεις και να προκαλέσουν βρασμό.
Τύποι διαμοριακών δυνάμεων
* Δυνάμεις διασποράς του Λονδίνου (LDF): Παρόν σε όλα τα μόρια. Προκύπτουν από προσωρινές διακυμάνσεις στη διανομή ηλεκτρονίων, δημιουργώντας προσωρινά διπόλια. Η ισχύς LDF αυξάνεται με μοριακό μέγεθος και επιφάνεια.
* Δυνάμεις διπόλης: Εμφανίζονται μεταξύ πολικών μορίων (μόρια με μόνιμα διπόλια).
* δεσμός υδρογόνου: Ένας ειδικός τύπος αλληλεπίδρασης διπολικού-δίπολου που συμβαίνει όταν το υδρογόνο συνδέεται με ένα εξαιρετικά ηλεκτροαρνητικό άτομο όπως το οξυγόνο, το άζωτο ή το φθόριο.
Ανάλυση των μορίων
* ne (neon): Ευγενές αέριο, μόνο LDF που υπάρχουν. Πολύ αδύναμο λόγω του μικρού μεγέθους του.
* n2 (άζωτο): Μη polol, μόνο LDF που υπάρχουν. Μεγαλύτερο από το NE, έτσι ώστε οι LDF να είναι ισχυρότερες.
* o2 (οξυγόνο): Μη polol, μόνο LDF που υπάρχουν. Ελαφρώς μεγαλύτερο από το N2, έτσι ώστε τα LDFs να είναι ελαφρώς ισχυρότερα.
* cl2 (χλώριο): Μη polol, μόνο LDF που υπάρχουν. Πολύ μεγαλύτερα από τα N2 και O2, έτσι τα LDFs είναι σημαντικά ισχυρότερα.
* SIH4 (σιλάνη): Ελαφρώς πολική (λόγω της διαφοράς στην ηλεκτροαρνητικότητα μεταξύ Si και H), αλλά η πολικότητα είναι πολύ αδύναμη. Η κυρίαρχη δύναμη είναι LDFS. Είναι μεγαλύτερο από το CL2, αλλά τα LDFs είναι ασθενέστερα λόγω της λιγότερο πολωμένης φύσης του δεσμού Si-H σε σύγκριση με τον δεσμό CL-Cl.
Συμπέρασμα
Με βάση αυτή την ανάλυση, το cl2 (χλώριο) θα έχει το υψηλότερο σημείο βρασμού Λόγω των σημαντικά ισχυρότερων δυνάμεων διασποράς του Λονδίνου λόγω του μεγάλου μεγέθους του.