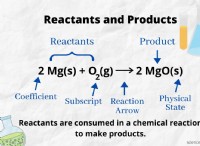
Ποια είναι η σκληρότητα των ιοντικών ενώσεων;
* Ισχυρές ηλεκτροστατικές δυνάμεις: Τα αντίθετα φορτισμένα ιόντα σε ιοντικές ενώσεις συγκρατούνται από ισχυρά ηλεκτροστατικά αξιοθέατα. Αυτές οι δυνάμεις απαιτούν σημαντική ενέργεια για να ξεπεραστεί, με αποτέλεσμα μια άκαμπτη δομή.
* Κλείσιμο συσκευασίας: Τα ιόντα σε ιοντικές ενώσεις τείνουν να συσκευάζουν σφιχτά μαζί, μεγιστοποιώντας τις ηλεκτροστατικές αλληλεπιδράσεις. Αυτή η στενή συσκευασία συμβάλλει στη σκληρότητα και την ακαμψία της δομής.
Παράγοντες που επηρεάζουν τη σκληρότητα σε ιοντικές ενώσεις:
* Πυκνότητα φόρτισης: Η υψηλότερη πυκνότητα φορτίου (μεγαλύτερο φορτίο στα μικρότερα ιόντα) οδηγεί σε ισχυρότερες ηλεκτροστατικές δυνάμεις και αυξημένη σκληρότητα.
* Ιονική ακτίνα: Μικρότερες ιοντικές ακτίνες οδηγούν σε στενότερη συσκευασία και ισχυρότερες δυνάμεις, οδηγώντας σε μεγαλύτερη σκληρότητα.
* Δομή πλέγματος: Η διάταξη των ιόντων στο κρύσταλλο πλέγμα μπορεί να επηρεάσει τη σκληρότητα. Για παράδειγμα, οι ενώσεις με μια πιο πολύπλοκη και σταθερή δομή πλέγματος τείνουν να είναι πιο δύσκολες.
Παραδείγματα:
* Diamond: Μία από τις πιο δύσκολες ουσίες, με μια ομοιοπολική δομή δικτύου.
* Χλωριούχο νάτριο (NaCl): Μια κοινή ιοντική ένωση, σχετικά σκληρή αλλά λιγότερο σκληρή από το διαμάντι.
* ανθρακικό ασβέστιο (CACO3): Μια άλλη κοινή ιοντική ένωση, με μέτρια σκληρότητα.
Εξαιρέσεις:
Ενώ οι περισσότερες ιοντικές ενώσεις είναι δύσκολες, υπάρχουν ορισμένες εξαιρέσεις. Για παράδειγμα, ορισμένες ιοντικές ενώσεις με μεγάλα ιόντα ή αδύναμες ηλεκτροστατικές δυνάμεις μπορεί να είναι σχετικά μαλακές.
Συνοπτικά:
Η σκληρότητα των ιοντικών ενώσεων είναι γενικά υψηλή λόγω των ισχυρών ηλεκτροστατικών δυνάμεων που συγκρατούν τα ιόντα μαζί. Ωστόσο, παράγοντες όπως η πυκνότητα φορτίου, η ιοντική ακτίνα και η δομή του πλέγματος μπορούν να επηρεάσουν τη σκληρότητα συγκεκριμένων ιοντικών ενώσεων.