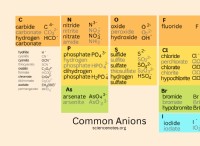
Είναι τα μόρια ιοντικών δεσμών ή ομοιοπολικών δεσμών;
Εδώ είναι μια κατανομή:
* Ιονικά ομόλογα μορφή όταν ένα άτομο δωρίζει Ένα ηλεκτρόνιο σε άλλο άτομο, δημιουργώντας αντίθετα φορτισμένα ιόντα που προσελκύονται μεταξύ τους. Αυτό συμβαίνει συνήθως μεταξύ ενός μετάλλου και ενός μη μέταλλου. Παραδείγματα ιοντικών ενώσεων περιλαμβάνουν:
* Χλωριούχο νάτριο (NaCl): Το νάτριο (Na) δωρίζει ένα ηλεκτρόνιο στο χλώριο (CL), με αποτέλεσμα τα Na+ και Cl-ions.
* οξείδιο μαγνησίου (MGO): Το μαγνήσιο (Mg) δωρίζει δύο ηλεκτρόνια σε οξυγόνο (Ο), με αποτέλεσμα Mg2+ και O2-ιόντα.
* ομοιοπολικά ομόλογα φόρμα όταν τα άτομα μοιράζονται ηλεκτρόνια. Αυτό συμβαίνει συνήθως μεταξύ των μη μεταλλικών. Παραδείγματα ομοιοπολικών ενώσεων περιλαμβάνουν:
* νερό (H2O): Τα άτομα υδρογόνου (Η) μοιράζονται ηλεκτρόνια με οξυγόνο (Ο).
* διοξείδιο του άνθρακα (CO2): Ο άνθρακας (C) μοιράζεται ηλεκτρόνια με οξυγόνο (Ο).
Βασική διαφορά:
* Ιονικά ομόλογα περιλαμβάνουν μεταφορά ηλεκτρονίων, με αποτέλεσμα ιόντα.
* ομοιοπολικά ομόλογα Περιλαμβάνει την ανταλλαγή ηλεκτρονίων, με αποτέλεσμα μια πιο ισορροπημένη κατανομή της φόρτισης.
Είναι σημαντικό να σημειώσετε:
* Ορισμένα μόρια μπορούν να περιέχουν τόσο ιοντικούς όσο και ομοιοπολικούς δεσμούς. Για παράδειγμα, το χλωριούχο αμμωνίου ένωσης (NH4Cl) έχει ιοντικό δεσμό μεταξύ NH4+ και CL-ιόντων, αλλά το ίδιο το ιόν αμμωνίου (NH4+) συγκρατείται από ομοιοπολικούς δεσμούς.
* Ο τύπος του δεσμού καθορίζει τις ιδιότητες του μορίου, όπως το σημείο τήξης, το σημείο βρασμού και τη διαλυτότητα.
Επιτρέψτε μου να ξέρω αν έχετε άλλες ερωτήσεις!