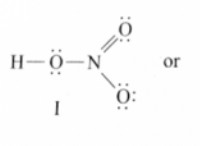
Γιατί το φθοριοειδές δεν σχηματίζει οξυοξείδιο;
Εδώ είναι μια κατανομή:
* Ηλεκτροργατιστικότητα: Το φθόριο είναι το πιο ηλεκτροαρνητικό στοιχείο, που σημαίνει ότι προσελκύει έντονα ηλεκτρόνια. Αυτό το καθιστά εξαιρετικά αντιδραστικό και τείνει να σχηματίζει ιοντικές ενώσεις και όχι ομοιοπολικές ενώσεις, οι οποίες είναι απαραίτητες για τα οξυοξείδια.
* Μικρό μέγεθος: Το μικρό μέγεθος του φθορίου περιορίζει την ικανότητά του να φιλοξενεί πολλαπλά άτομα οξυγόνου γύρω από αυτό, τα οποία απαιτούνται για το σχηματισμό οξυοξείων.
Σχηματισμός οξυοκιδιού:
Τα οξυοξείδια σχηματίζονται όταν ένα μη μέταλλο άτομο (όπως το χλώριο, το βρώμιο ή το ιωδικό) δεσμεύει με άτομα οξυγόνου και μία ή περισσότερες ομάδες υδροξυλίου (ΟΗ). Το μη μέταλλο άτομο είναι συνήθως σε θετική κατάσταση οξείδωσης.
Ωστόσο, η υψηλή ηλεκτροαρνητικότητα του φθορίου την εμποδίζει να σχηματίσει μια θετική κατάσταση οξείδωσης. Είναι πάντα στην κατάσταση οξείδωσης στις ενώσεις της, καθιστώντας την αδυναμία να ενεργεί ως κεντρικό άτομο σε ένα οξυόμο.
Αντί των οξυοξείων, το φθόριο σχηματίζει ισχυρά οξέα όπως το υδροφθορικό οξύ (HF).
Συνοπτικά:
Η υψηλή ηλεκτροαρνητικότητα και το μικρό μέγεθος του φθορίου καθιστούν δύσκολη τη σχηματισμό οξυοξείων. Προτιμά να σχηματίσει ιοντικές ενώσεις ή απλά οξέα όπως το HF.