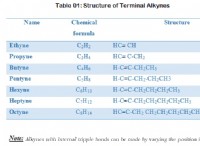
Ποια είναι η τιμή της σταθεράς ισορροπίας στα 25 και DEGC για την αντίδραση μεταξύ CR (S) Cu2 Plus (AQ);
1. Η αντίδραση:
Η αντίδραση που περιγράφετε είναι μια αντίδραση οξειδοαναγωγής όπου το μεταλλικό χρωμίου (Cr) μειώνει τα ιόντα χαλκού (II) (Cu2⁺) στο χαλκό μέταλλο (Cu), ενώ το ίδιο το χρωμίου παίρνει οξειδωμένο σε ιόντα χρωμίου (II) (Cr2⁺).
Η ισορροπημένη χημική εξίσωση είναι:
Cr (s) + cu²⁺ (aq) ⇌ cr²⁺ (aq) + cu (s)
2. Τυπικά δυναμικά ηλεκτροδίων:
Για να προσδιορίσουμε τη σταθερά ισορροπίας (k), χρειαζόμαστε τα τυπικά δυναμικά μείωσης (E °) για τις μισές αντιδράσεις:
* cr³⁺ (aq) + 3e⁻ → cr (s) E ° =-0,74 V (αυτό είναι το αντίστροφο της οξείδωσης του CR)
* cu²⁺ (aq) + 2e⁻ → cu (s) E ° =+0,34 V
3. Υπολογισμός του κυτταρικού δυναμικού (E ° Cell):
Το κυτταρικό δυναμικό (E ° Cell) για τη συνολική αντίδραση υπολογίζεται ως:
E ° Cell =E ° (Cathode) - E ° (άνοδος)
* Καθεάνα: Η μείωση του CU2 είναι όπου συμβαίνει μείωση (κέρδος των ηλεκτρονίων).
* Άνοψη: Η οξείδωση του CR είναι όπου συμβαίνει η οξείδωση (απώλεια ηλεκτρονίων).
Επομένως:
E ° Cell =+0.34 V - (-0.74 V) =+1.08 V
4. Σχετικά με το δυναμικό κυττάρου με σταθερά ισορροπίας:
Η σχέση μεταξύ του τυπικού κυτταρικού δυναμικού (E ° Cell) και της σταθεράς ισορροπίας (k) δίνεται από την εξίσωση Nernst:
E ° Cell =(RT/NF) * Ln (K)
Οπου:
* R =Ιδανική σταθερά αερίου (8.314 J/mol · k)
* T =θερμοκρασία σε Kelvin (25 ° C =298 K)
* n =αριθμός γραμμομορίων ηλεκτρονίων που μεταφέρονται (2 σε αυτήν την αντίδραση)
* F =σταθερή Faraday (96.485 C/mol)
Επίλυση για k:
ln (k) =(nf * e ° cell) / rt
K =exp [(nf * e ° Cell) / rt]
5. Υπολογισμός:
Συνδέστε τις τιμές:
K =exp [((2 mol e⁻) (96.485 c/mol) (+1.08 V))/(8.314 j/mol · k) (298 k)]
K ≈ 1,3 x 10³⁷
Ως εκ τούτου, η τιμή της σταθεράς ισορροπίας (k) για την αντίδραση μεταξύ Cr (s) και Cu²⁺ (aq) στους 25 ° C είναι περίπου 1,3 x 10 ⁷ ⁷. Αυτή η εξαιρετικά μεγάλη τιμή υποδεικνύει ότι η αντίδραση ευνοεί έντονα το σχηματισμό προϊόντων (Cr²⁺ και Cu).