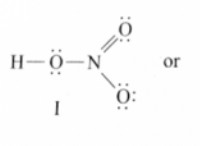
Τι αντιδρά το ίδιο με το χλώριο;
ομοιότητες με άλλα αλογόνα:
* Άλλα αλογόνα (φθόριο, βρωμίρο, ιώδιο) Μοιραστείτε παρόμοιες χημικές ιδιότητες λόγω της ύπαρξης στην ίδια ομάδα (ομάδα 17) του περιοδικού πίνακα. Όλοι έχουν υψηλή ηλεκτροαρνητικότητα και τείνουν να κερδίζουν ένα ηλεκτρόνιο για να σχηματίσουν ένα αρνητικό ιόν (αλογονίδιο).
* Παρόμοιες αντιδράσεις: Το χλώριο, το βρώμιο και το ιώδιο μπορούν όλοι:
* Αντιδράστε με μέταλλα για να σχηματίσουν μεταλλικά αλογονίδια.
* Αντιδράστε με υδρογόνο για να σχηματίσουν αλογονίδια υδρογόνου.
* Αντιδράστε με άλλα μη μέταλλα για να σχηματίσουν ομοιοπολικές ενώσεις.
* Λειτουργεί ως οξειδωτικοί παράγοντες (ηλεκτρόνια κέρδους).
Διαφορές από άλλα αλογόνα:
* Αντιδραστικότητα: Το χλώριο είναι πιο αντιδραστικό από το βρωμίρο και το ιώδιο, αλλά λιγότερο αντιδραστικό από το φθόριο. Αυτό σημαίνει ότι το χλώριο θα αντιδράσει πιο εύκολα με κάποιες ουσίες.
* Ειδικές αντιδράσεις: Ενώ τα γενικά πρότυπα αντιδραστικότητας είναι παρόμοια, υπάρχουν ορισμένες ειδικές αντιδράσεις που μόνο το χλώριο θα υποβληθεί (ή θα υποβληθεί σε διαφορετικό αποτέλεσμα) λόγω των μοναδικών του ιδιοτήτων.
Σημαντική σημείωση: Η αντιδραστικότητα του χλωρίου μπορεί να είναι δραστικά διαφορετική ανάλογα με τις συνθήκες. Για παράδειγμα:
* Παρουσία νερού: Το χλώριο αντιδρά με νερό για να σχηματίσει υποχλωριώδες οξύ (HOCL), ισχυρό οξειδωτικό παράγοντα και υδροχλωρικό οξύ (HCl). Αυτός είναι ο λόγος για τον οποίο το χλώριο χρησιμοποιείται ως απολυμαντικό.
* Παρουσία φωτός: Το χλώριο μπορεί να αντιδράσει με οργανικές ενώσεις σε μια διαδικασία που ονομάζεται χλωρίωση, η οποία μπορεί να είναι επικίνδυνη.
Συνοπτικά, ενώ άλλα αλογόνα μοιράζονται ορισμένα πρότυπα αντιδραστικότητας με χλώριο, δεν είναι πανομοιότυπα. Το χλώριο έχει τις δικές του μοναδικές ιδιότητες και αντιδραστικότητα που το καθιστούν ένα ξεχωριστό στοιχείο.