Διαφορά μεταξύ απλών διπλών και τριπλών ομολόγων
Κύρια διαφορά – Μονό έναντι διπλού έναντι τριπλού δεσμού
Οι χημικοί δεσμοί συγκρατούν τα άτομα σε ένα μόριο ενωμένα, εγκαθιδρύοντας δυνάμεις μεταξύ των ηλεκτρονίων και των πυρήνων δύο ατόμων. Οι χημικές αντιδράσεις διέπονται από τη δημιουργία ή το σπάσιμο των χημικών δεσμών. Υπάρχουν διάφοροι τύποι δεσμών όπως ο ομοιοπολικός, ο ιονικός, ο van der Waal κ.λπ. Οι ιδιότητες των δεσμών ποικίλλουν ανάλογα με διάφορες πτυχές όπως η φύση του μορίου, ο στερεός τύπος (κρυσταλλικός ή άμορφος) κ.λπ. Οι ομοιοπολικοί δεσμοί σχηματίζονται με κοινή χρήση δύο ή περισσότερα ηλεκτρόνια. Ο αριθμός των κοινών ηλεκτρονίων μεταξύ των ατόμων καθορίζει τον αριθμό των δεσμών. είτε είναι μονό, διπλό ή τριπλό. Επομένως, οι απλοί, οι διπλοί και οι τριπλοί δεσμοί είναι ομοιοπολικοί δεσμοί. Η κύρια διαφορά μεταξύ απλού διπλού και τριπλού δεσμού είναι ο αριθμός των κοινών ηλεκτρονίων. Εάν ο κοινός αριθμός είναι ένα ζεύγος ηλεκτρονίων, ο δεσμός θα είναι ένας απλός δεσμός, ενώ εάν δύο άτομα συνδέονται με δύο ζεύγη (τέσσερα ηλεκτρόνια), θα σχηματίσει διπλό δεσμό. Οι τριπλοί δεσμοί σχηματίζονται με την κοινή χρήση τριών ζευγών (έξι ατόμων) ηλεκτρονίων. Αυτά τα ηλεκτρόνια κοινής χρήσης είναι κοινώς γνωστά ως ηλεκτρόνια σθένους. Αυτό το άρθρο θα εξετάσει,
1. Τι είναι ένας απλός δεσμός;
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι ο Διπλός Δεσμός;
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Τι είναι ο τριπλός δεσμός;
– Ορισμός, Ιδιότητες, Παραδείγματα
4. Ποια είναι η διαφορά μεταξύ των απλών διπλών και τριπλών ομολόγων; 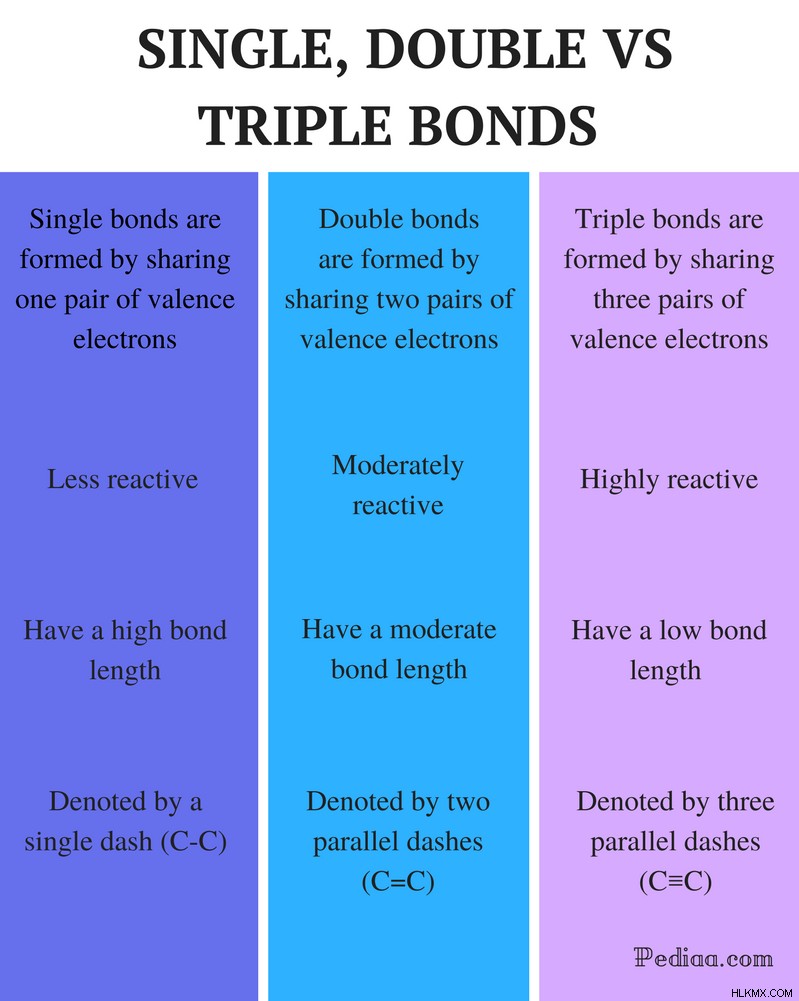
Τι είναι ένας απλός δεσμός
Σχηματίζεται ένας απλός δεσμός με την κοινή χρήση ενός ζεύγους ηλεκτρονίων σθένους μεταξύ δύο γειτονικών ατόμων. Ένας απλός δεσμός είναι η απλούστερη μορφή ενός ομοιοπολικού δεσμού, όπου κάθε άτομο παρέχει ένα ηλεκτρόνιο σθένους. Αυτά τα ηλεκτρόνια σθένους βρίσκονται στο πιο εξωτερικό κέλυφος των ατόμων. Εδώ, τα αρνητικά φορτισμένα κοινά ηλεκτρόνια έλκονται από τους θετικά φορτισμένους πυρήνες των ατόμων. Αυτές οι δυνάμεις έλξης συγκρατούν τα άτομα μαζί. Αυτή η ρύθμιση είναι γνωστή ως ενιαίος δεσμός. Τα μόρια με απλούς δεσμούς είναι λιγότερο αντιδραστικά σε αντίθεση με τα μόρια με πολλαπλούς δεσμούς. Επιπλέον, είναι πιο αδύναμοι από τους πολλαπλούς δεσμούς και έχουν μεγαλύτερα μήκη δεσμού λόγω της χαμηλής δύναμης έλξης μεταξύ των ατόμων σε σύγκριση με πολλαπλούς δεσμούς. Ένας απλός δεσμός συμβολίζεται με μία μόνο παύλα. π.χ:C ̶ C. Τα αλκάνια όπως το μεθάνιο, το αιθάνιο, το προπάνιο είναι μερικά παραδείγματα για ενώσεις με απλούς δεσμούς.
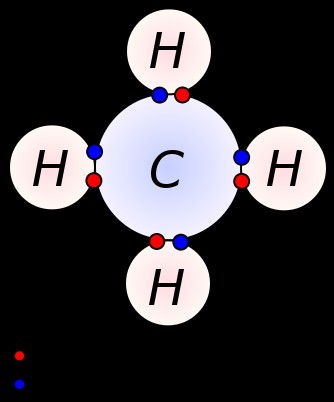
Μεθάνιο
Τι είναι διπλός δεσμός
Ένας διπλός δεσμός σχηματίζεται με την κοινή χρήση δύο ζευγών ηλεκτρονίων σθένους που βρίσκονται στην εξώτατη τροχιά των ατόμων. Οι ενώσεις με διπλούς δεσμούς είναι πολύ αντιδραστικές από τις ενώσεις με απλούς δεσμούς αλλά λιγότερο αντιδραστικές από τις ενώσεις με τριπλούς δεσμούς. Οι διπλοί δεσμοί συμβολίζονται με δύο παράλληλες παύλες. π.χ.:C=C. Μερικά παραδείγματα ενώσεων με διπλούς δεσμούς περιλαμβάνουν αλκένια όπως αιθυλένιο, προπένιο, καρβονυλικές ενώσεις (C=O), αζωενώσεις (N=N), ιμίνες (C=N) και σουλφοξείδια (S=O).
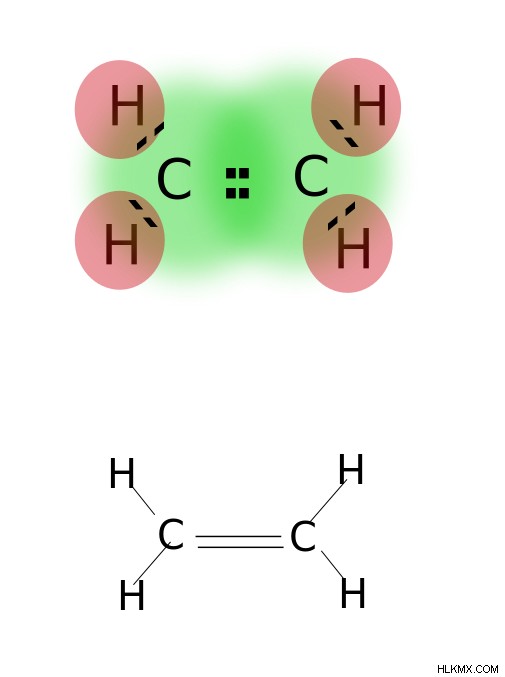
Αιθυλένιο
Τι είναι ο τριπλός δεσμός
Όταν δύο άτομα μοιράζονται τρία ζεύγη ηλεκτρονίων σθένους (έξι ηλεκτρόνια σθένους), οι καθιερωμένοι δεσμοί ονομάζονται τριπλοί δεσμοί. Οι τριπλοί δεσμοί είναι οι ισχυρότεροι και οι πιο αντιδραστικοί ομοιοπολικοί δεσμοί. Σε σύγκριση με απλούς και διπλούς δεσμούς, οι τριπλοί δεσμοί έχουν το χαμηλότερο μήκος δεσμού λόγω της υψηλότερης δύναμης έλξης μεταξύ δύο ατόμων. Ένας τριπλός δεσμός συμβολίζεται με τρεις παράλληλες παύλες μεταξύ δύο ατόμων. π.χ.:C≡C. Μερικά παραδείγματα ενώσεων με τριπλούς δεσμούς περιλαμβάνουν αέριο άζωτο (N≡N), ιόν κυανιδίου (C≡N), ακετυλένιο (CH≡CH) και μονοξείδιο του άνθρακα (C≡O).

Ακετυλένιο
Διαφορά μεταξύ απλών διπλών και τριπλών δεσμών
Ορισμός:
Single Bond: Ένας απλός δεσμός σχηματίζεται με την κοινή χρήση ενός ζεύγους ηλεκτρονίων σθένους.
Διπλό Ομόλογο: Ένας διπλός δεσμός σχηματίζεται με την κοινή χρήση δύο ζευγών ηλεκτρονίων σθένους.
Triple Bond: Ένας τριπλός δεσμός σχηματίζεται με την κοινή χρήση τριών ζευγών ηλεκτρονίων σθένους.
Αντιδραστικότητα:
Μονόδεσμο: Τα μεμονωμένα ομόλογα είναι λιγότερο αντιδραστικά.
Διπλό Ομόλογο: Οι διπλοί δεσμοί είναι μέτρια αντιδραστικοί.
Τριπλός δεσμός: Οι τριπλοί δεσμοί είναι εξαιρετικά αντιδραστικοί.
Μήκος δεσμού:
Single Bond: Οι απλοί δεσμοί έχουν μεγάλο μήκος δεσμού.
Διπλό Ομόλογο: Οι διπλοί δεσμοί έχουν μέτριο μήκος δεσμού.
Triple Bond: Οι τριπλοί δεσμοί έχουν χαμηλή αντοχή δεσμού.
Σημανίζεται με:
Single Bond: Οι απλοί δεσμοί συμβολίζονται με μία παύλα (C-C).
Διπλό Ομόλογο: Οι διπλοί δεσμοί συμβολίζονται με δύο παράλληλες παύλες (C=C).
Triple Bond: Οι τριπλοί δεσμοί συμβολίζονται με τρεις παράλληλες παύλες (C≡C).
Παραδείγματα:
Single Bond: Στα παραδείγματα περιλαμβάνονται αλκάνια όπως μεθάνιο, αιθάνιο, προπάνιο, βουτάνιο κ.λπ.
Διπλός δεσμός: Παραδείγματα περιλαμβάνουν αιθυλένιο, προπένιο, καρβονυλικές ενώσεις (C=O), αζωενώσεις (N=N), ιμίνες (C=N) και σουλφοξείδια (S=O).
Τριπλός δεσμός: Παραδείγματα περιλαμβάνουν αέριο άζωτο (N≡N), ιόν κυανιδίου (C≡N), ακετυλένιο (CH≡CH) και μονοξείδιο του άνθρακα (C≡O).
Παραπομπές:
Clowes, Martin. Τα Βασικά της Οργανικής Χημείας . N.p.:The Rosen Publishing Group, 2013. Print.Cracolice, Mark S. Βασικά στοιχεία εισαγωγικής χημείας με κριτική μαθηματικών . Μη προσδιορισμένος τόπος δημοσίευσης:Brooks Cole, 2006. Print.Manahan, Stanley E. Fundamentals of Environmental Chemistry . 3η έκδ. N.p.:CRC Press, 2011. Print.Gray, Harry B., John D. Simon, and William C. Trogler. Θαυμάστε τα στοιχεία . Sausalito, CA:U Science , 1995. Εκτύπωση. Ευγενική προσφορά εικόνας: "Covalent" από DynaBlast – Δημιουργήθηκε με Inkscape (CC BY-SA 2.5) μέσω Commons Wikimedia "AzetylenElektr" Με δική μου εργασία – Ф. А. Деркач “Хімія” Л. 1968 (Δημόσιος Τομέας) μέσω Commons Wikimedia "Etheen" Από τον Jcwf στο nl.wikibooks (CC BY-SA 2.5) μέσω του Commons Wikimedia




