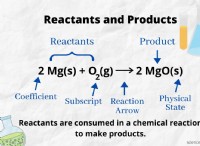
Γιατί το χλώριο είναι πιο χημικά αντιδραστικό από το οξυγόνο;
* Ηλεκτροργατιστικότητα: Το οξυγόνο έχει υψηλότερη ηλεκτροαρνητικότητα από το χλώριο. Αυτό σημαίνει ότι το οξυγόνο έχει ισχυρότερη έλξη στα ηλεκτρόνια σε χημικό δεσμό. Αυτό κάνει το οξυγόνο πιο πιθανό να κερδίσει ηλεκτρόνια και να σχηματίσει αρνητικά ιόντα, οδηγώντας σε πιο αντιδραστική συμπεριφορά.
* συγγένεια ηλεκτρονίων: Το οξυγόνο έχει υψηλότερη συγγένεια ηλεκτρονίων από το χλώριο. Αυτό σημαίνει ότι το οξυγόνο απελευθερώνει περισσότερη ενέργεια όταν κερδίζει ένα ηλεκτρόνιο, καθιστώντας το πιο ενεργά ευνοϊκό για το οξυγόνο να συμμετέχει σε αντιδράσεις.
* Μικρότερο μέγεθος: Τα άτομα οξυγόνου είναι μικρότερα από τα άτομα χλωρίου. Αυτό σημαίνει ότι τα ηλεκτρόνια στο οξυγόνο διατηρούνται πιο σφιχτά από τον πυρήνα, καθιστώντας τα πιο διαθέσιμα για συγκόλληση και αντιδράσεις.
* Διαθεσιμότητα ηλεκτρονίων σθένους: Τόσο το οξυγόνο όσο και το χλώριο έχουν έξι ηλεκτρόνια σθένους, αλλά το οξυγόνο είναι πιο πιθανό να κερδίσει δύο ηλεκτρόνια για να επιτύχει μια σταθερή διαμόρφωση οκτάδων. Το χλώριο, από την άλλη πλευρά, είναι πιο πιθανό να κερδίσει ένα ηλεκτρόνιο για να επιτύχει ένα σταθερό οκτάτο. Αυτό καθιστά το οξυγόνο πιο αντιδραστικό σε καταστάσεις όπου μπορεί εύκολα να κερδίσει δύο ηλεκτρόνια.
Συνοπτικά: Η υψηλότερη ηλεκτροαρνητικότητα του οξυγόνου, η ισχυρότερη συγγένεια ηλεκτρονίων, το μικρότερο μέγεθος και η ευκολία με την οποία μπορεί να κερδίσει δύο ηλεκτρόνια το καθιστούν πιο χημικά αντιδραστικό από το χλώριο.