Ο ορισμός των οξέων και βάσεων του Arrhenius
Το 1884, ένας Σουηδός επιστήμονας ονόματι Svante Arrhenius εργάστηκε στη θεωρία του ιονισμού και, σε αυτή τη βάση, προσπάθησε να εξηγήσει τα χαρακτηριστικά των οξέων και των βάσεων. Στη θεωρία που πρότεινε ο Svante, εξήγησε πώς θα αντιδρούσε το οξύ όταν αναμιγνύεται με νερό και πώς θα αντιδρούσε μια βάση όταν διατηρηθεί μαζί με το νερό. Ως αποτέλεσμα, φάνηκε ότι όταν αναμιγνύουμε νερό και οξύ μαζί, το οξύ θα απελευθερώσει ιόντα Η+ στο διάλυμα, αποδεικνύοντας ότι τα οξέα έχουν περιεκτικότητα σε υδρογόνο. Από την άλλη πλευρά, αν αναμίξουμε νερό και μια βάση, τότε η βάση που υπάρχει στο διάλυμα θα απελευθερώσει ιόντα ΟΗ- που διασπώνται με το νερό.
Όταν ένας ηλεκτρολύτης διαλύεται στο νερό, διαχωρίζεται σε ηλεκτρικά θετικά και αρνητικά φορτισμένα ιόντα ως κατιόντα και ανιόντα, αντίστοιχα, που θεωρούνται ιονισμός. Ο Arrhenius προσπάθησε να δώσει τη διάκριση μεταξύ οξέος και βάσης με βάση την έννοια του ίσου.
Διαφορά μεταξύ οξέων και βάσεων
Οξέα Arrhenius
Σύμφωνα με τον Arrhenius, οξύ είναι κάθε είδος που θα επεκτείνει το ενδιαφέρον των ιόντων υδρογόνου σε ένα υδατικό διάλυμα, ή έτσι νόμιζε! Όταν κάνουμε ένα υδατικό διάλυμα υδροχλωρικού οξέος για όλες τις προθέσεις και σκοπούς, το διάλυμα διασπάται σε ιόντα υδρογόνου και χλωρίου ως προϊόντα της αντίστοιχης αντίδρασης, κάτι που είναι αρκετά σημαντικό. Δεδομένου ότι αυτές οι συνέπειες επιφέρουν μια αύξηση στον σχηματισμό ιόντων υδρογόνου σε διάλυμα, το υδροχλωρικό οξύ, συγκεκριμένα, είναι ένα οξύ Arrhenius με εξευγενισμένο τρόπο.
Στην πράξη, όταν η αντίδραση λαμβάνει χώρα σε εργαστηριακή βάση, τα θετικά φορτισμένα πρωτόνια αντιδρούν κανονικά με τα γύρω μόρια του νερού για να σχηματίσουν ιόντα υδρονίου, αντίθετα με τη δημοφιλή πεποίθηση, ή έτσι πίστευαν κυρίως. Και αυτό είναι το πραγματικό που συμβαίνει τη στιγμή της αντίδρασης, αλλά οι επιστήμονες παίρνουν τα ιόντα υδρονίου ισοδύναμα με ιόντα υδρογόνου. Έτσι προκύπτει το αποτέλεσμα, που είναι πιο κοινό σε όλους. Αυτή η απάντηση μπορεί να αποδειχθεί μέσω ενός πολύ συνηθισμένου παραδείγματος διαθήκης που θα δείξει πώς οι παραπάνω πληροφορίες μπορούν να αποδειχθούν σωστές και στην πραγματικότητα να γραφτούν ως εξής:
H+ (aq) + H2O (l) → H3O+ (aq)
Σαν άμεσο αποτέλεσμα, ο σχηματισμός ιόντων υδρονίου παρατηρείται όταν το οξύ διασπάται με το νερό. Αυτό χρησιμοποιείται ως επί το πλείστον καθώς οι επιστήμονες λαμβάνουν υπόψη ότι τα ιόντα υδρογόνου και τα ιόντα υδρονίου βρίσκονται σε παρόμοια βάση ενώ μιλούν για μια χημική αντίδραση.
Βάσεις Arrhenius
Η βάση Arrhenius είναι ένα είδος που διασπάται με το νερό για να δώσει ιόντα υδροξυλίου. Αυξάνει τη συγκέντρωση του ιόντος υδροξυλίου στο υδατικό διάλυμα.
Παράδειγμα βάσης Arrhenius:Ένα παράδειγμα αυτού είναι το εξαιρετικά διαλυτό υδροξείδιο του νατρίου. Το υδροξείδιο του νατρίου διασπάται στο νερό ως εξής:
NaOH (aq) → Na+ (aq) + OH– (aq)
Arrhenius Acid + Arrhenius Base
Όταν ένα οξύ και μια βάση υπομένουν μια χημική απόκριση και σχηματίζουν δεσμό μεταξύ τους κατά τη διάρκεια της διαδικασίας, η αντίδραση είναι γνωστό ότι είναι μια αντίδραση εξουδετέρωσης. Τα προϊόντα που τελικά αγοράζονται ως αποτέλεσμα είναι νερό και αλάτι.
Όταν κατά τη διάρκεια της διάστασης του οξέος σε νερό παράγει ιόντα υδρογόνου και από την άλλη πλευρά η διάσπαση της βάσης σε νερό παράγει ιόντα υδροξειδίου, αυτό μας προσφέρει την πρωταρχική τεχνογνωσία για το πώς το νερό και το αλάτι δημιουργούνται για τη διάρκεια της απόκρισης τόσο του οξέος όσο και της βάσης.
Το ιόν υδρογόνου που παράγεται από την πλευρά του οξέος και το ιόν υδροξειδίου που παράγεται από την πλευρά της βάσης αναμιγνύονται μεταξύ τους και ως αποτέλεσμα, λαμβάνουμε νερό. Τα είδη οξέος και βάσης που έχουν μείνει έξω ενώνουν τα χέρια για να διαμορφώσουν το αλάτι.
Ας υποθέσουμε, για παράδειγμα; συνδυάζουμε ένα υδατικό διάλυμα υδροφθορικού οξέος και υδροξειδίου του λιθίου, τότε θα γίνει η ακόλουθη αντίδραση:
HF (aq) ⇄ H+ (aq) + F– (aq)
Και ως αποτέλεσμα, τα προϊόντα που σχηματίζονται θα υποστούν την αύξουσα αντίδραση με τη σειρά για να σχηματιστεί νερό και αλάτι ως τελικό προϊόν. 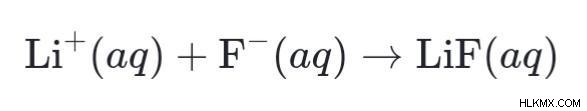
LiOH (aq) → Li+ (aq) + OH– (aq)
Περιορισμός της θεωρίας του Arrhenius των οξέων και βάσεων :-
Αυτή η θεωρία ισχύει μόνο για οξέα και βάσεις στο υδατικό διάλυμα.
H+ (aq) + OH– (aq) →H2O (l)
Συμπέρασμα
Ένας επιστήμονας ονόματι Svante Arrhenius έδωσε τη δημοφιλή «θεωρία των οξέων και βάσεων του Arrhenius», τα αντίστοιχα χαρακτηριστικά τους παρουσία υδατικού διαλύματος και πώς η θεωρία ιονισμού σχετίζεται με αυτό, για την οποία έλαβε βραβείο Νόμπελ επισης. Όμως η θεωρία περιοριζόταν στο υδατικό διάλυμα και δεν μπορούσε να ικανοποιήσει τα χαρακτηριστικά του μη υδατικού διαλύματος, που είναι ο περιορισμός της θεωρίας του οξέος και της βάσης του Arrhenius.




