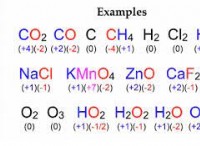
Ποιος είναι ο αριθμός οξείδωσης στον άνθρακα στο C2H6;
Κανόνες για την εκχώρηση αριθμών οξείδωσης
* Δωρεάν στοιχεία: Ο αριθμός οξείδωσης είναι 0.
* μονοτομικά ιόντα: Ο αριθμός οξείδωσης ισούται με το φορτίο του ιόντος.
* οξυγόνο: Συνήθως -2, εκτός από τα υπεροξείδια (-1) και όταν συνδέονται με φθορίνη (+2).
* υδρογόνο: Συνήθως +1, εκτός από τα μεταλλικά υδρίδια (-1).
* Το άθροισμα των αριθμών οξείδωσης σε ένα ουδέτερο μόριο είναι 0.
* Το άθροισμα των αριθμών οξείδωσης σε ένα πολυατομικό ιόν ισούται με το φορτίο του ιόντος
Εφαρμογή των κανόνων στο C2H6
1. Υδρογόνο: Κάθε άτομο υδρογόνου έχει αριθμό οξείδωσης +1.
2. Συνολικός αριθμός οξείδωσης για υδρογόνο: Δεδομένου ότι υπάρχουν έξι άτομα υδρογόνου, ο συνολικός αριθμός οξείδωσης για υδρογόνο είναι +6.
3. άνθρακα: Για να γίνει το μόριο ουδέτερο, τα δύο άτομα άνθρακα πρέπει να έχουν συνδυασμένο αριθμό οξείδωσης -6.
4. Αριθμός οξείδωσης κάθε άνθρακα: Δεδομένου ότι υπάρχουν δύο άτομα άνθρακα, κάθε άτομο άνθρακα έχει αριθμό οξείδωσης -3.
Επομένως, ο αριθμός οξείδωσης του άνθρακα στο C2H6 είναι -3.